- •Вопрос 1),2),3): основные законы химии – сохранения массы, энергии, постоянства состава, Авогадро.
- •Вопрос 4): основные классы неорганических соединений.
- •Вопрос 5): Модель строения атома Резерфорда.
- •Вопрос 6): теория строения атома Бора. Недостатки этой теории.
- •Вопрос 7): принципы квантовой механики: дискретность энергии, корпускулярно-волновой дуализм, принцип неопределенности Гейзенберга.
- •Вопрос 8): уравнение Шредингера, основные идеи положенные в его основу. Смысл волновой функции.
- •Вопрос 9): Квантовые числа их значение и сущность.
- •Вопрос 10): понятие электронного уровня, подуровня, орбитали.
- •Вопрос 11): правила заполнения электронных уровней и подуровней.
- •Вопрос 12): s-,d-,p-,f-элементы. Положение в периодической системе и особенности электронного строения их атомов.
- •Вопрос 13): Закон Менделеева. Периодичность заряда и тд.
- •Вопрос 15),16),17),18),19),20),21),22),23): химическая связь. Виды хим. Связи. Энерг. Характеристики хим. Связи.
- •Вопрос 24): метод молекулярных орбиталей. Основные понятия.
- •Вопрос 25): описать методом мо некоторые соединения
- •Вопрос 26): Ионная связь, ее св-ва. Основные виды кристаллических решеток.
- •Вопрос 27): металлическая связь.
- •Вопрос 28): межмолекулярное взаимодействие. Оринетационный, индукционный и дисперсионный моменты.
- •Вопрос 29): водородная связь.
- •Вопрос 30): основные типы крист. Решеток.
- •Вопрос 31): основные законы термохимии. Следствия из законов Гесса.
- •Вопрос 32): внутренняя энергия системы, понятие энтальпии и энтропии.
- •Вопрос 33): энергия Гиббса, анализ уравнения Гиббса.
- •Вопрос 34): скорость химических реакций. Следствия из законов Гесса.
- •Вопрос 34),35): факторы, влияющие на скорость хим. Реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •Вопрос 37): гетерогенные реакции. Влиянии диффузии и степени дискретности.
- •Вопрос 38): влияние катализатора. Причины влияние катализатора.
- •Вопрос 39): обратимые процессы. Хим. Равновесие. Константа равновесия.
- •Вопрос 40): влияние различных факторов на смещение равновесия. Принцип Ле-Шателье.
- •Вопрос 41): определение раствора. Физико-химические процессы при образовании раствора. Энтальпия и энтропия при растворении.
- •Вопрос 42): способы выражения концентрации раствора.
- •Вопрос 43): закон Рауля.
- •Вопрос 44): Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •Вопрос 45): раствор электролитов. Сильные и слабые электролиты. Степень диссоциации. Изотонический коэффициент.
- •Вопрос 46): теория электролитической диссоциации. Физическая Аррениуса, Химическая Менделеева и современный взгляд на диссоциацию.
- •Вопрос 47): Реакция в растворах электролитов, их направленность, смещение равновесия.
- •Вопрос 48): ионное произведение воды. Водородный показатель.
- •Вопрос 49): гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •Вопрос 50): Гидролиз соли и все что с ним связано.
- •Вопрос 51): Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •Вопрос 53): Гальванические элементы; процессы на электродах; эдс гальванического элемента:
- •Вопрос 54): Обратимые источники электрической энергии; кислотные и щелочные аккумуляторы:
- •Вопрос 55): Топливные элементы:
- •Вопрос 56): Электролиз растворов и расплавов; последовательность электродных процессов; перенапряжение и поляризация:
- •Вопрос 59): Применение электролиза в промышленности:
- •Вопрос 60): Электрохимическая коррозия металлов; основные виды электрохимической коррозии; процессы на электродах
- •Вопрос 61): Методы борьбы с коррозией
Вопрос 15),16),17),18),19),20),21),22),23): химическая связь. Виды хим. Связи. Энерг. Характеристики хим. Связи.
Ковалентная связь – в ней разделяют два типа. 1) Неполярную - у двух атомов электроотрицательность(способность атома притягивать электронную плотность = первый потенциал(энергия для отсоединения первого электрона)+сродство к электрону, делить сумму на два,(фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары)) примерно равны, и электронная плотность находится на одинаковом расстоянии от центров этих атомов. 2) Полярную – когда электроотрицательность одного атома больше и электронная плотность смещена ближе к этому атому (дельта хи больше нуля и меньше 1.7). Характеризуется: насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей., направленность – направление связи, поляризуемость – образование частично положительного и отрицательного зарядов.
Обменный механизм заключается в том, что один атом дает электрон, а другой ячейку под этот электрон. Валентность элемента – кол-во связей, которые он может образовать. Соответственно, возбужденное состояние – это когда электроны распариваются, соответственно, элемент может образовать другие случае, нежели когда электроны были спарены, так как меняется количество свободных электронов и ячеек.
Донорно-акцепторный механизм — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора.
Ионная связь – предельный случай ковалентной полярной. Не является насыщенной (вокруг иона может быть много атомов, что не происходит из-за размерных факторов) и ненаправленной.
Водородная – связь в молекулах по Кулоновским законам между Н+ и сильно электроотрицательным элементом.
Основные положения ВС – предпологает, что связь между атомами образуется за счет общей электронной пары, которая образуется за счет взаимодействия электронов внешних уровней. Атомы взаимодействую по мин. Расстоянию. Связь тем прочнее, чем больше перекрывание электронных облаков.
Валентные возможности – кол-во соединений, которые может образовывать атом.
Валентность - пособность свободных его атомов к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей.
Теор. Гибридизации – если в образовании связи принимают участие электроны разных подуровней (имеют разную форму электронных облаков), то происходит их объединение (гибридизация) и из разных по форме облаков образуется такое же количество одинаковых по форме.
Полярность связи характеризует степень смещения общей электронной пары к одному из атомов.
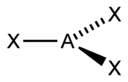
Тип гибридизации |
Число гибридных орбиталей |
Геометрия |
Структура |
Примеры |
sp |
2 |
Линейная |
|
BeF2, CO2, NO2+ |
sp2 |
3 |
Треугольная |
|
BF3, NO3-, CO32- |
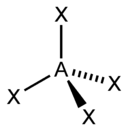
sp3 |
4 |
Тетраэдрическая |
|
CH4, ClO4-, SO42-, NH4+ |
dsp2 |
4 |
Плоскоквадратная |
|
Ni(CO)4, [PdCl4]2- |
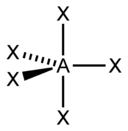
sp3d |
5 |
Гексаэдрическая
|
|
PCl5, AsF5 |
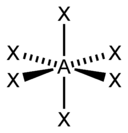
sp3d2 |
6 |
Октаэдрическая |
|
SF6, Fe(CN)63-, CoF63- |
Недостатки метода ВС – не может предсказать реальный угол, не может объяснить существование многоцентровых молекул.