
- •Вопрос 1),2),3): основные законы химии – сохранения массы, энергии, постоянства состава, Авогадро.
- •Вопрос 4): основные классы неорганических соединений.
- •Вопрос 5): Модель строения атома Резерфорда.
- •Вопрос 6): теория строения атома Бора. Недостатки этой теории.
- •Вопрос 7): принципы квантовой механики: дискретность энергии, корпускулярно-волновой дуализм, принцип неопределенности Гейзенберга.
- •Вопрос 8): уравнение Шредингера, основные идеи положенные в его основу. Смысл волновой функции.
- •Вопрос 9): Квантовые числа их значение и сущность.
- •Вопрос 10): понятие электронного уровня, подуровня, орбитали.
- •Вопрос 11): правила заполнения электронных уровней и подуровней.
- •Вопрос 12): s-,d-,p-,f-элементы. Положение в периодической системе и особенности электронного строения их атомов.
- •Вопрос 13): Закон Менделеева. Периодичность заряда и тд.
- •Вопрос 15),16),17),18),19),20),21),22),23): химическая связь. Виды хим. Связи. Энерг. Характеристики хим. Связи.
- •Вопрос 24): метод молекулярных орбиталей. Основные понятия.
- •Вопрос 25): описать методом мо некоторые соединения
- •Вопрос 26): Ионная связь, ее св-ва. Основные виды кристаллических решеток.
- •Вопрос 27): металлическая связь.
- •Вопрос 28): межмолекулярное взаимодействие. Оринетационный, индукционный и дисперсионный моменты.
- •Вопрос 29): водородная связь.
- •Вопрос 30): основные типы крист. Решеток.
- •Вопрос 31): основные законы термохимии. Следствия из законов Гесса.
- •Вопрос 32): внутренняя энергия системы, понятие энтальпии и энтропии.
- •Вопрос 33): энергия Гиббса, анализ уравнения Гиббса.
- •Вопрос 34): скорость химических реакций. Следствия из законов Гесса.
- •Вопрос 34),35): факторы, влияющие на скорость хим. Реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •Вопрос 37): гетерогенные реакции. Влиянии диффузии и степени дискретности.
- •Вопрос 38): влияние катализатора. Причины влияние катализатора.
- •Вопрос 39): обратимые процессы. Хим. Равновесие. Константа равновесия.
- •Вопрос 40): влияние различных факторов на смещение равновесия. Принцип Ле-Шателье.
- •Вопрос 41): определение раствора. Физико-химические процессы при образовании раствора. Энтальпия и энтропия при растворении.
- •Вопрос 42): способы выражения концентрации раствора.
- •Вопрос 43): закон Рауля.
- •Вопрос 44): Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •Вопрос 45): раствор электролитов. Сильные и слабые электролиты. Степень диссоциации. Изотонический коэффициент.
- •Вопрос 46): теория электролитической диссоциации. Физическая Аррениуса, Химическая Менделеева и современный взгляд на диссоциацию.
- •Вопрос 47): Реакция в растворах электролитов, их направленность, смещение равновесия.
- •Вопрос 48): ионное произведение воды. Водородный показатель.
- •Вопрос 49): гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •Вопрос 50): Гидролиз соли и все что с ним связано.
- •Вопрос 51): Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •Вопрос 53): Гальванические элементы; процессы на электродах; эдс гальванического элемента:
- •Вопрос 54): Обратимые источники электрической энергии; кислотные и щелочные аккумуляторы:
- •Вопрос 55): Топливные элементы:
- •Вопрос 56): Электролиз растворов и расплавов; последовательность электродных процессов; перенапряжение и поляризация:
- •Вопрос 59): Применение электролиза в промышленности:
- •Вопрос 60): Электрохимическая коррозия металлов; основные виды электрохимической коррозии; процессы на электродах
- •Вопрос 61): Методы борьбы с коррозией
Вопрос 12): s-,d-,p-,f-элементы. Положение в периодической системе и особенности электронного строения их атомов.
s-,d-,p-,f- элементами называют элементы, у которых формируются s-,d-,p-,f- подуровни. В периодической системе они находятся столбцами (длинный вариант таблицы Менделеева). Особенность их электронного строения в том, что, так как у них подуровни не завершены, то они могут как принимать так и отдавать электроны.
Вопрос 13): Закон Менделеева. Периодичность заряда и тд.
Периодический закон – Д. И. Менделеев формулировал его так: свойства хим элементов, а так же форма и свойства образуемых ими соединений находятся в периодической зависимости от величины атомного веса. Однако, позже, другие ученые выяснили, что этот закон справедлив за одной поправкой – не атомным весом а зарядом ядра. Периодическая система – графическое выражение периодического закона. С помощью Таблицы элементов Менделеев мог предсказывать свойства еще не открытых элементов, беря свойства элементов выше, ниже, правее, левея и находя их усредненные свойства. Когда в мире науки поняли, что пер закон Менделеева, а так же таблица носят предсказательный характер, они получили мировое признание. Важно отметить, что свойства элемента определяет структура внешнего уровня
Энергия ионизации – та энергия, которую необходимо затратить чтобы удалить электрон из атома на бесконечное расстояние. Численное ее значение часто называют потенциалом ионизации (этот потенциал является экспериментально измеренным данным). Важнейшим значением является первый потенциал ионизации – потенциал ионизации удаления первого, самого дальнего элекрона.
На энергию ионизации атома наиболее существенное влияние оказывают следующие факторы:
-эффективный заряд ядра, являющийся функцией числа электронов в атоме, экранирующих ядро и расположенных на более глубоко лежащих внутренних орбиталях;
-радиальное расстояние от ядра до максимума зарядовой плотности наружного, наиболее слабо -связанного с атомом и покидающего его при ионизации, электрона;
-мера проникающей способности этого электрона;
-межэлектронное отталкивание среди наружных (валентных) электронов.
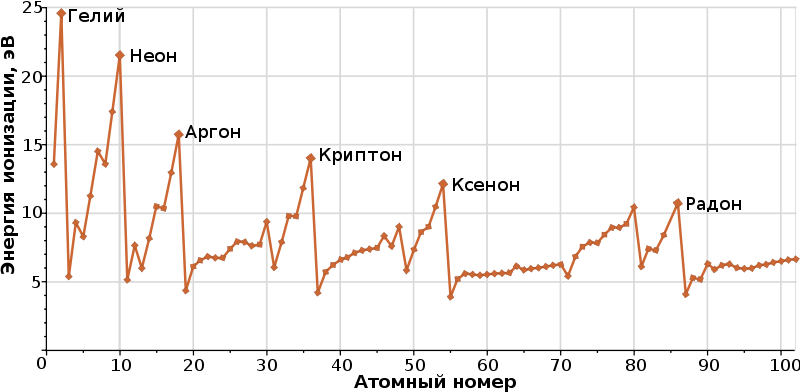
Падение объясняется появлением непарного электрона.
Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As)
Эле́ктроотрица́тельность (χ) — способность атомов притягивать электронную плотность (фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары). В группах сверху вниз показатель ее падает, в периодах справа налево падает.
