
- •Вопрос 1),2),3): основные законы химии – сохранения массы, энергии, постоянства состава, Авогадро.
- •Вопрос 4): основные классы неорганических соединений.
- •Вопрос 5): Модель строения атома Резерфорда.
- •Вопрос 6): теория строения атома Бора. Недостатки этой теории.
- •Вопрос 7): принципы квантовой механики: дискретность энергии, корпускулярно-волновой дуализм, принцип неопределенности Гейзенберга.
- •Вопрос 8): уравнение Шредингера, основные идеи положенные в его основу. Смысл волновой функции.
- •Вопрос 9): Квантовые числа их значение и сущность.
- •Вопрос 10): понятие электронного уровня, подуровня, орбитали.
- •Вопрос 11): правила заполнения электронных уровней и подуровней.
- •Вопрос 12): s-,d-,p-,f-элементы. Положение в периодической системе и особенности электронного строения их атомов.
- •Вопрос 13): Закон Менделеева. Периодичность заряда и тд.
- •Вопрос 15),16),17),18),19),20),21),22),23): химическая связь. Виды хим. Связи. Энерг. Характеристики хим. Связи.
- •Вопрос 24): метод молекулярных орбиталей. Основные понятия.
- •Вопрос 25): описать методом мо некоторые соединения
- •Вопрос 26): Ионная связь, ее св-ва. Основные виды кристаллических решеток.
- •Вопрос 27): металлическая связь.
- •Вопрос 28): межмолекулярное взаимодействие. Оринетационный, индукционный и дисперсионный моменты.
- •Вопрос 29): водородная связь.
- •Вопрос 30): основные типы крист. Решеток.
- •Вопрос 31): основные законы термохимии. Следствия из законов Гесса.
- •Вопрос 32): внутренняя энергия системы, понятие энтальпии и энтропии.
- •Вопрос 33): энергия Гиббса, анализ уравнения Гиббса.
- •Вопрос 34): скорость химических реакций. Следствия из законов Гесса.
- •Вопрос 34),35): факторы, влияющие на скорость хим. Реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •Вопрос 37): гетерогенные реакции. Влиянии диффузии и степени дискретности.
- •Вопрос 38): влияние катализатора. Причины влияние катализатора.
- •Вопрос 39): обратимые процессы. Хим. Равновесие. Константа равновесия.
- •Вопрос 40): влияние различных факторов на смещение равновесия. Принцип Ле-Шателье.
- •Вопрос 41): определение раствора. Физико-химические процессы при образовании раствора. Энтальпия и энтропия при растворении.
- •Вопрос 42): способы выражения концентрации раствора.
- •Вопрос 43): закон Рауля.
- •Вопрос 44): Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •Вопрос 45): раствор электролитов. Сильные и слабые электролиты. Степень диссоциации. Изотонический коэффициент.
- •Вопрос 46): теория электролитической диссоциации. Физическая Аррениуса, Химическая Менделеева и современный взгляд на диссоциацию.
- •Вопрос 47): Реакция в растворах электролитов, их направленность, смещение равновесия.
- •Вопрос 48): ионное произведение воды. Водородный показатель.
- •Вопрос 49): гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •Вопрос 50): Гидролиз соли и все что с ним связано.
- •Вопрос 51): Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •Вопрос 53): Гальванические элементы; процессы на электродах; эдс гальванического элемента:
- •Вопрос 54): Обратимые источники электрической энергии; кислотные и щелочные аккумуляторы:
- •Вопрос 55): Топливные элементы:
- •Вопрос 56): Электролиз растворов и расплавов; последовательность электродных процессов; перенапряжение и поляризация:
- •Вопрос 59): Применение электролиза в промышленности:
- •Вопрос 60): Электрохимическая коррозия металлов; основные виды электрохимической коррозии; процессы на электродах
- •Вопрос 61): Методы борьбы с коррозией
Вопрос 5): Модель строения атома Резерфорда.
П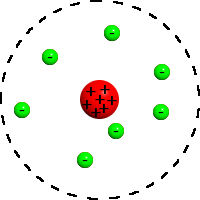 ланетарная
модель атома, или модель Резерфорда, -
предложил Эрнест
Резерфорд
в результате эксперимента с рассеиванием
альфа-частиц.
По этой модели атом состоит из небольшого
положительно заряженного ядра,
в котором сосредоточена почти вся масса
атома, вокруг которого движутся электроны,
- подобно тому, как планеты движутся
вокруг Солнца.
ланетарная
модель атома, или модель Резерфорда, -
предложил Эрнест
Резерфорд
в результате эксперимента с рассеиванием
альфа-частиц.
По этой модели атом состоит из небольшого
положительно заряженного ядра,
в котором сосредоточена почти вся масса
атома, вокруг которого движутся электроны,
- подобно тому, как планеты движутся
вокруг Солнца.
Недостаток: с точки зрения классической электродинамики, электрон, двигаясь вокруг ядра, должен был бы излучать непрерывно и очень быстро, потеряв энергию, упасть на ядро.
Вопрос 6): теория строения атома Бора. Недостатки этой теории.
БМА— полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка.
![]() где
где ![]() —
излучённая (поглощённая) энергия,
—
излучённая (поглощённая) энергия, ![]() —
номера квантовых
состояний.
В спектроскопии
—
номера квантовых
состояний.
В спектроскопии ![]() и
и ![]() называются термами.
называются термами.
Правило квантования момента
импульса: ![]()
![]()
Недостатки теории Бора – 1) Не смогла объяснить интенсивность (скалярная, количественно характеризующая мощность, переносимую волной в направлении распространения) спектральных линий. 2) Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева. 3) Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое.
Теория Бора являлась недостаточно последовательной и общей. Поэтому она в дальнейшем была заменена современной квантовой механикой, основанной на более общих и непротиворечивых исходных положениях. Сейчас известно, что постулаты Бора являются следствиями более общих квантовых законов. Но правила квантования широко используются и в наши дни как приближенные соотношения: их точность часто бывает очень высокой.
Вопрос 7): принципы квантовой механики: дискретность энергии, корпускулярно-волновой дуализм, принцип неопределенности Гейзенберга.
Дискретность
энергии –
Квантовая гипотеза
Планка состояла
в том, что для элементарных
частиц,
любая энергия поглощается или испускается
только дискретными порциями (квантами).
Эти порции состоят из целого числа
квантов с такой энергией ![]() ,
что эта энергия пропорциональна
частоте ν с
коэффициентом пропорциональности,
определённым по формуле: Е=аш*ню.
,
что эта энергия пропорциональна
частоте ν с
коэффициентом пропорциональности,
определённым по формуле: Е=аш*ню.
Корпускуля́рно-волново́й
дуали́зм — принцип,
согласно которому любой объект может
проявлять как волновые,
так и корпускулярные свойства.
На
деле квантовые объекты не являются ни
классическими волнами, ни классическими
частицами, приобретая свойства первых
или вторых лишь в некотором приближении. Де
Бройль выдвинул идею о том, что волновой
характер распространения, установленный
для фотонов, имеет универсальный
характер. Он должен проявляться для
любых частиц, обладающих импульсом ![]() .
Все частицы, имеющие конечный импульс
,
обладают волновыми свойствами, в
частности подвержены интерференции и
дифракции.
.
Все частицы, имеющие конечный импульс
,
обладают волновыми свойствами, в
частности подвержены интерференции и
дифракции.
Формула де
Бройля устанавливает
зависимость длины волны ![]() ,
связанной с движущейся частицей вещества,
от импульса
частицы:
,
связанной с движущейся частицей вещества,
от импульса
частицы:
![]()
Формула де Бройля экспериментально подтверждается опытами по рассеянию электронов и других частиц на кристаллах и по прохождению частиц сквозь вещества.
Принцип неопределенности Гейзенберга – 1) Неопределенность между координатой и импульсом
Пусть ![]() — среднеквадратическое
отклонение координаты
частицы
— среднеквадратическое
отклонение координаты
частицы ![]() ,
движущейся вдоль оси
,
движущейся вдоль оси ![]() ,
и
,
и ![]() —
среднеквадратическое отклонение
ее импульса.
Величины
и
связаны
следующим неравенством:
—
среднеквадратическое отклонение
ее импульса.
Величины
и
связаны
следующим неравенством:
![]()
где ![]() —
постоянная Планка, а
—
постоянная Планка, а ![]()
Согласно соотношению неопределённостей, невозможно абсолютно точно определить одновременно координаты и импульс частицы. С повышением точности измерения координаты, максимальная точность измерения импульса уменьшается и наоборот.
2) Неопределенность между энергией и временем
Пусть ΔЕ — среднеквадратическое отклонение энергии частицы, и Δt — время, требуемое для обнаружения частицы. Время Δt для обнаружения частицы с энергией E±ΔЕ определяется следующим неравенством:
![]()
