
- •Вопрос 1),2),3): основные законы химии – сохранения массы, энергии, постоянства состава, Авогадро.
- •Вопрос 4): основные классы неорганических соединений.
- •Вопрос 5): Модель строения атома Резерфорда.
- •Вопрос 6): теория строения атома Бора. Недостатки этой теории.
- •Вопрос 7): принципы квантовой механики: дискретность энергии, корпускулярно-волновой дуализм, принцип неопределенности Гейзенберга.
- •Вопрос 8): уравнение Шредингера, основные идеи положенные в его основу. Смысл волновой функции.
- •Вопрос 9): Квантовые числа их значение и сущность.
- •Вопрос 10): понятие электронного уровня, подуровня, орбитали.
- •Вопрос 11): правила заполнения электронных уровней и подуровней.
- •Вопрос 12): s-,d-,p-,f-элементы. Положение в периодической системе и особенности электронного строения их атомов.
- •Вопрос 13): Закон Менделеева. Периодичность заряда и тд.
- •Вопрос 15),16),17),18),19),20),21),22),23): химическая связь. Виды хим. Связи. Энерг. Характеристики хим. Связи.
- •Вопрос 24): метод молекулярных орбиталей. Основные понятия.
- •Вопрос 25): описать методом мо некоторые соединения
- •Вопрос 26): Ионная связь, ее св-ва. Основные виды кристаллических решеток.
- •Вопрос 27): металлическая связь.
- •Вопрос 28): межмолекулярное взаимодействие. Оринетационный, индукционный и дисперсионный моменты.
- •Вопрос 29): водородная связь.
- •Вопрос 30): основные типы крист. Решеток.
- •Вопрос 31): основные законы термохимии. Следствия из законов Гесса.
- •Вопрос 32): внутренняя энергия системы, понятие энтальпии и энтропии.
- •Вопрос 33): энергия Гиббса, анализ уравнения Гиббса.
- •Вопрос 34): скорость химических реакций. Следствия из законов Гесса.
- •Вопрос 34),35): факторы, влияющие на скорость хим. Реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •Вопрос 37): гетерогенные реакции. Влиянии диффузии и степени дискретности.
- •Вопрос 38): влияние катализатора. Причины влияние катализатора.
- •Вопрос 39): обратимые процессы. Хим. Равновесие. Константа равновесия.
- •Вопрос 40): влияние различных факторов на смещение равновесия. Принцип Ле-Шателье.
- •Вопрос 41): определение раствора. Физико-химические процессы при образовании раствора. Энтальпия и энтропия при растворении.
- •Вопрос 42): способы выражения концентрации раствора.
- •Вопрос 43): закон Рауля.
- •Вопрос 44): Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •Вопрос 45): раствор электролитов. Сильные и слабые электролиты. Степень диссоциации. Изотонический коэффициент.
- •Вопрос 46): теория электролитической диссоциации. Физическая Аррениуса, Химическая Менделеева и современный взгляд на диссоциацию.
- •Вопрос 47): Реакция в растворах электролитов, их направленность, смещение равновесия.
- •Вопрос 48): ионное произведение воды. Водородный показатель.
- •Вопрос 49): гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •Вопрос 50): Гидролиз соли и все что с ним связано.
- •Вопрос 51): Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •Вопрос 53): Гальванические элементы; процессы на электродах; эдс гальванического элемента:
- •Вопрос 54): Обратимые источники электрической энергии; кислотные и щелочные аккумуляторы:
- •Вопрос 55): Топливные элементы:
- •Вопрос 56): Электролиз растворов и расплавов; последовательность электродных процессов; перенапряжение и поляризация:
- •Вопрос 59): Применение электролиза в промышленности:
- •Вопрос 60): Электрохимическая коррозия металлов; основные виды электрохимической коррозии; процессы на электродах
- •Вопрос 61): Методы борьбы с коррозией
Вопрос 53): Гальванические элементы; процессы на электродах; эдс гальванического элемента:
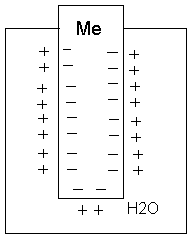
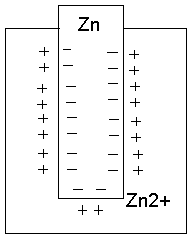
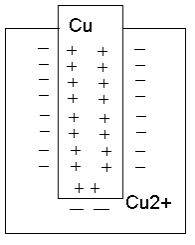
Любой металл (мб и ничтожно мало) растворяется в воде, что обусловлено возрастанием энтропии при растворении(стремление к разупорядочению). При этом в раствор переходят +ионы Ме. В металле же остаются избыточные своб. электроны, т.е. на границе возникает двойной электрический слой, электр. поле в кот. направлено так, что препятствует дальнейшему растворению металла в воде. В результате нарушения усл. электроотрицательности и возникновения на границе раздела разности потенциалов ионы Ме скапливаются в тонком приповерхностном слое раствора (Метал. электрод заряжен -, а в поверхностном растворе концентрируются + гидратированные катионы Ме) . И эта приповерхностная концентрации (Cs) может сильно отличаться для разных Ме. Если погрузить мет. электрод в раствор его соли то могут реализоваться 2 механизма образования двойного электрического слоя.У Химически активных Ме (Zn,Cd,Co и т.п.) Cs>Ci (Ci концентрация соли) и Ме заряжается отриц. У неактивных Ме (Cu,Ag,Au) Cs<Ci и электрод заряжается полож., а в приэлектродном пространстве накапливаются ОН-.
Устройства, которые применяют для непосредственног преобразования энергии химической реакции в электролитическую энергию, называют гальваническими элементами.
Н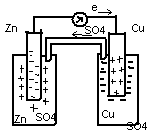 а
границе металл-раствор происходит
окислительно-восстановительная реакция,
благодаря которой появляется ЭДС.
Появление движущей силы химической
реакции обуславливается убылью свободной
энергии Гиббса ∆G. С другой стороны
убыль энергии Гиббса определяет
максимальную работу химической реакции.
Для реакции, осуществляемой в условиях
гальванического элемента, работа А,
производимая системой, равна A=IUt=QU.
(Q-количество электричества). Если в
системе протекает ток, то часть энергии
системы расходуется на выделение
джоулевой теплоты и процесс протекает
необратимо. Максимальную работу Гальв.
Эл-т совершает, если реакция протекает
обратимо в равновесных условиях. Это
возможно при I=0, кодга ЭДС скомпенсирована
равной по величине и противоположной
по знаку внешней ЭДС. При этом условии
U=E. Amax=QE. -∆G=Amax=nFE.(F-постоянная
Фарадея; n-число электронов, принимаемых
или отдаваемых вещ-м(заряд иона))
а
границе металл-раствор происходит
окислительно-восстановительная реакция,
благодаря которой появляется ЭДС.
Появление движущей силы химической
реакции обуславливается убылью свободной
энергии Гиббса ∆G. С другой стороны
убыль энергии Гиббса определяет
максимальную работу химической реакции.
Для реакции, осуществляемой в условиях
гальванического элемента, работа А,
производимая системой, равна A=IUt=QU.
(Q-количество электричества). Если в
системе протекает ток, то часть энергии
системы расходуется на выделение
джоулевой теплоты и процесс протекает
необратимо. Максимальную работу Гальв.
Эл-т совершает, если реакция протекает
обратимо в равновесных условиях. Это
возможно при I=0, кодга ЭДС скомпенсирована
равной по величине и противоположной
по знаку внешней ЭДС. При этом условии
U=E. Amax=QE. -∆G=Amax=nFE.(F-постоянная
Фарадея; n-число электронов, принимаемых
или отдаваемых вещ-м(заряд иона))
Согласно этим уравнениям, процесс протекает самопроизвольно тогда, когда эдс эл-та положительна. Рассмотрим гальванический элемент, состоящий из медного и цинкового электродов в растворах их солей.
Для определения ЭДС сравнивают стандартные электродные потенциалы цинкового и медного полуэлементов.
Zn2++2e-=Zn0; E0(Zn2+/Zn0)=-0,76В Cu2++2e-=Сu0; E0(Cu2+/Cu0)=+0,34В
Отрицательный знак E0 свидетельствует о том, что переход цинка из окисленной формы в восстановленную самопроизвольно протекать не может. Термодинамически возможен обратный процесс, тогда E0 будет положительна. Таким образом осуществляются следующие реакции: анодный процесс: Zn0=Zn2++2e- (окисление цинка) и катодный: Cu2++2e-=Cu0 (восстановление меди) E системы будет равно E0(Zn0/Zn2+)+ E0(Cu2+/Cu0)=0,34В+0,76В=1,10В. Положительный знак ЭДС определяет направление самопроизвольного протекания реакции(слева направо; цинк восстанавливает медь)
