
- •Вопрос 1),2),3): основные законы химии – сохранения массы, энергии, постоянства состава, Авогадро.
- •Вопрос 4): основные классы неорганических соединений.
- •Вопрос 5): Модель строения атома Резерфорда.
- •Вопрос 6): теория строения атома Бора. Недостатки этой теории.
- •Вопрос 7): принципы квантовой механики: дискретность энергии, корпускулярно-волновой дуализм, принцип неопределенности Гейзенберга.
- •Вопрос 8): уравнение Шредингера, основные идеи положенные в его основу. Смысл волновой функции.
- •Вопрос 9): Квантовые числа их значение и сущность.
- •Вопрос 10): понятие электронного уровня, подуровня, орбитали.
- •Вопрос 11): правила заполнения электронных уровней и подуровней.
- •Вопрос 12): s-,d-,p-,f-элементы. Положение в периодической системе и особенности электронного строения их атомов.
- •Вопрос 13): Закон Менделеева. Периодичность заряда и тд.
- •Вопрос 15),16),17),18),19),20),21),22),23): химическая связь. Виды хим. Связи. Энерг. Характеристики хим. Связи.
- •Вопрос 24): метод молекулярных орбиталей. Основные понятия.
- •Вопрос 25): описать методом мо некоторые соединения
- •Вопрос 26): Ионная связь, ее св-ва. Основные виды кристаллических решеток.
- •Вопрос 27): металлическая связь.
- •Вопрос 28): межмолекулярное взаимодействие. Оринетационный, индукционный и дисперсионный моменты.
- •Вопрос 29): водородная связь.
- •Вопрос 30): основные типы крист. Решеток.
- •Вопрос 31): основные законы термохимии. Следствия из законов Гесса.
- •Вопрос 32): внутренняя энергия системы, понятие энтальпии и энтропии.
- •Вопрос 33): энергия Гиббса, анализ уравнения Гиббса.
- •Вопрос 34): скорость химических реакций. Следствия из законов Гесса.
- •Вопрос 34),35): факторы, влияющие на скорость хим. Реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •Вопрос 37): гетерогенные реакции. Влиянии диффузии и степени дискретности.
- •Вопрос 38): влияние катализатора. Причины влияние катализатора.
- •Вопрос 39): обратимые процессы. Хим. Равновесие. Константа равновесия.
- •Вопрос 40): влияние различных факторов на смещение равновесия. Принцип Ле-Шателье.
- •Вопрос 41): определение раствора. Физико-химические процессы при образовании раствора. Энтальпия и энтропия при растворении.
- •Вопрос 42): способы выражения концентрации раствора.
- •Вопрос 43): закон Рауля.
- •Вопрос 44): Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •Вопрос 45): раствор электролитов. Сильные и слабые электролиты. Степень диссоциации. Изотонический коэффициент.
- •Вопрос 46): теория электролитической диссоциации. Физическая Аррениуса, Химическая Менделеева и современный взгляд на диссоциацию.
- •Вопрос 47): Реакция в растворах электролитов, их направленность, смещение равновесия.
- •Вопрос 48): ионное произведение воды. Водородный показатель.
- •Вопрос 49): гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •Вопрос 50): Гидролиз соли и все что с ним связано.
- •Вопрос 51): Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •Вопрос 53): Гальванические элементы; процессы на электродах; эдс гальванического элемента:
- •Вопрос 54): Обратимые источники электрической энергии; кислотные и щелочные аккумуляторы:
- •Вопрос 55): Топливные элементы:
- •Вопрос 56): Электролиз растворов и расплавов; последовательность электродных процессов; перенапряжение и поляризация:
- •Вопрос 59): Применение электролиза в промышленности:
- •Вопрос 60): Электрохимическая коррозия металлов; основные виды электрохимической коррозии; процессы на электродах
- •Вопрос 61): Методы борьбы с коррозией
Вопрос 47): Реакция в растворах электролитов, их направленность, смещение равновесия.
Равновесие в растворах электролитов остается неизменным, пока не изменятся определяющие его условия. По принципу Ле Шателье на равновесие влияет концентрация. При увеличении количества каких-либо ионов, они связываются с другими. CH3COOH = H++CH3COO-. Если добавить какую-либо соль уксусной кислоты, то увеличится концентрация ионов CH3COO-. Равновесие сместится влево. (степень диссоциации уксусной кислоты уменьшается) Введение в раствор слабого электролита одноименных ионов уменьшает степень диссоциации этого электролита. Если же взять малорастворимый электролит, то всякий раз как только произведение концентраций превысит величину произведения растворимости, появится осадок. (пр: сульфат кальция)
Обязательным условием протекания реакции является удаление из раствора тех или иных ионов. Например, образованием слабодиссациируемого вещества, или веществ в виде осадка или газа.
При нейтрализации сильной кислоты сильным основанием в растворе образуется только один слабый электролит – вода. Причем в реакции H++OH-=H2O равновесие очень сильно смещено вправо, что показывает, что реакция проходит практически до конца.
А при нейтрализации слабой кислоты и слабого основания, получаются минимум два слабых электролита: вода и слабая кислота или основание. Например, при нейтрализации уксусной кислоты получается:
H++CH3COO-=CH3COOH H++OH-=H2O
Таким образом, ион водорода может связаться либо в молекулу уксусной кислоты или в молекулу воды. Ионы CH3COO и OH как б конкурируют друг с другом в связывании иона водорода. Поэтому в данном случае реакция доходит не до конца, а до некоего состояния равновесия CH3COOH+OH-=CH3COO-+H2O
Однако равновесие смещено вправо, так как вода более слабый электролит, чем уксусная кислота.
При нейтрализации слабого основания сильной кислотой в растворе тоже устанавливаются два равновесия:
NH4++OH-=NH4OH H++OH-=H2O
Конкурируют NH4+ и H+. В результате: H++NH4OH=NH4++H2O. Равновесие смещается вправо.
Вопрос 48): ионное произведение воды. Водородный показатель.
вода, хоть и является слабым электролитом, в малой степени диссоциирует на катионы Н+ и анионы ОН- . Тогда, константу диссоциации воды можно рассчитать по формуле К=([ Н+]*[ ОН-])/[Н2О] (**). Концентрация молекул Н2О в воде, учитывая её малую степень диссоциации, величина практически постоянная и =плотность воды/молярную массу (1000 г/л)/(18 г/моль) = 55,56 моль/л. При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Тогда, уравнение (**) можно переписать как К*[Н2О]= [ Н+]*[ ОН-]. Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C). Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. В нейтральной среде [H+]=[OH-]=10-7.
Водородный показатель введен для удобства, как десятичный логарифм концентрации катионов водорода, pH= -lg[H+]. В нейтральной среде рН=7, при связывании гидроксид анионов их концентрация падает, а концентрация катионов водорода возрастает, в следствие чего реакция среды становится кислой рН<7, при связывании катионов водорода их концентрация падает, а концентрация гидроксид анионов возрастает, в следствие чего реакция среды становится щелочной рН>7.
Водородный показатель (рассчет):
Для характеристики кислотно-основных свойств растворов используют водородный показатель рН, равный отрицательному значению десятичного логарифма концентрации ионов водорода. Аналогично рассчитывают гидроксильный показатель рОН, равный отрицательному значению десятичного логарифма концентрации ионов гидроксила:
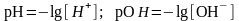 .
(4.13)
.
(4.13)
Концентрации ионов водорода и гидроксила связаны между собой равновесием диссоциации воды:
Н2О Н+ + ОН.
Константу равновесия называют ионным произведением воды. При 298 К константа равновесия
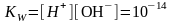 .
.
Прологарифмировав это уравнение, получим
рН + рОН = 14.
В чистой воде (нейтральная среда) рН = рОН = 7. В кислой среде рН 7, в щелочной среде рН 7.
