
- •Вопрос 1),2),3): основные законы химии – сохранения массы, энергии, постоянства состава, Авогадро.
- •Вопрос 4): основные классы неорганических соединений.
- •Вопрос 5): Модель строения атома Резерфорда.
- •Вопрос 6): теория строения атома Бора. Недостатки этой теории.
- •Вопрос 7): принципы квантовой механики: дискретность энергии, корпускулярно-волновой дуализм, принцип неопределенности Гейзенберга.
- •Вопрос 8): уравнение Шредингера, основные идеи положенные в его основу. Смысл волновой функции.
- •Вопрос 9): Квантовые числа их значение и сущность.
- •Вопрос 10): понятие электронного уровня, подуровня, орбитали.
- •Вопрос 11): правила заполнения электронных уровней и подуровней.
- •Вопрос 12): s-,d-,p-,f-элементы. Положение в периодической системе и особенности электронного строения их атомов.
- •Вопрос 13): Закон Менделеева. Периодичность заряда и тд.
- •Вопрос 15),16),17),18),19),20),21),22),23): химическая связь. Виды хим. Связи. Энерг. Характеристики хим. Связи.
- •Вопрос 24): метод молекулярных орбиталей. Основные понятия.
- •Вопрос 25): описать методом мо некоторые соединения
- •Вопрос 26): Ионная связь, ее св-ва. Основные виды кристаллических решеток.
- •Вопрос 27): металлическая связь.
- •Вопрос 28): межмолекулярное взаимодействие. Оринетационный, индукционный и дисперсионный моменты.
- •Вопрос 29): водородная связь.
- •Вопрос 30): основные типы крист. Решеток.
- •Вопрос 31): основные законы термохимии. Следствия из законов Гесса.
- •Вопрос 32): внутренняя энергия системы, понятие энтальпии и энтропии.
- •Вопрос 33): энергия Гиббса, анализ уравнения Гиббса.
- •Вопрос 34): скорость химических реакций. Следствия из законов Гесса.
- •Вопрос 34),35): факторы, влияющие на скорость хим. Реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •Вопрос 37): гетерогенные реакции. Влиянии диффузии и степени дискретности.
- •Вопрос 38): влияние катализатора. Причины влияние катализатора.
- •Вопрос 39): обратимые процессы. Хим. Равновесие. Константа равновесия.
- •Вопрос 40): влияние различных факторов на смещение равновесия. Принцип Ле-Шателье.
- •Вопрос 41): определение раствора. Физико-химические процессы при образовании раствора. Энтальпия и энтропия при растворении.
- •Вопрос 42): способы выражения концентрации раствора.
- •Вопрос 43): закон Рауля.
- •Вопрос 44): Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •Вопрос 45): раствор электролитов. Сильные и слабые электролиты. Степень диссоциации. Изотонический коэффициент.
- •Вопрос 46): теория электролитической диссоциации. Физическая Аррениуса, Химическая Менделеева и современный взгляд на диссоциацию.
- •Вопрос 47): Реакция в растворах электролитов, их направленность, смещение равновесия.
- •Вопрос 48): ионное произведение воды. Водородный показатель.
- •Вопрос 49): гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •Вопрос 50): Гидролиз соли и все что с ним связано.
- •Вопрос 51): Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •Вопрос 53): Гальванические элементы; процессы на электродах; эдс гальванического элемента:
- •Вопрос 54): Обратимые источники электрической энергии; кислотные и щелочные аккумуляторы:
- •Вопрос 55): Топливные элементы:
- •Вопрос 56): Электролиз растворов и расплавов; последовательность электродных процессов; перенапряжение и поляризация:
- •Вопрос 59): Применение электролиза в промышленности:
- •Вопрос 60): Электрохимическая коррозия металлов; основные виды электрохимической коррозии; процессы на электродах
- •Вопрос 61): Методы борьбы с коррозией
Вопрос 46): теория электролитической диссоциации. Физическая Аррениуса, Химическая Менделеева и современный взгляд на диссоциацию.
Теория ЭД - Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс . Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа:
![]()
Константа
диссоциации ![]() определяется активностями катионов
определяется активностями катионов ![]() , анионов
, анионов ![]() и
недиссоциированных молекул
и
недиссоциированных молекул ![]() следующим
образом:
следующим
образом:
![]()
Значение зависит от природы растворённого вещества и растворителя, а также от температуры и может быть определено несколькими экспериментальными методами. Степень диссоциации (α) может быть рассчитана при любой концентрации электролита с помощью соотношения:
![]() ,
,
где ![]() —
средний коэффициент активности
электролита.
—
средний коэффициент активности
электролита.
ФА – 1) Соли, кислоты и основания при растворении в воде и некоторых других полярных растворителях диссоциируют на ионы. 2) Ионы существуют в растворе независимо от того, проходит через раствор электрический ток или нет. Вследствие этого число независимо движущихся частиц растворенного вещества больше, чем при отсутствии диссоциации, и коллигативные свойства электролитов возрастают в i раз. 3) Процесс диссоциации описывается законом действующих масс (протекает обратимо). При уменьшении концентрации диссоциация становится практически полной
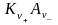 ↔ ν+ Kz+ + ν – Az-
↔ ν+ Kz+ + ν – Az-
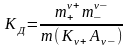

В частном случае при ν+=ν–=1
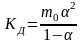 (*)
(*)
Здесь ν=ν++ν– - общее число ионов, образующихся при диссоциации одной молекулы,
m+, m– - моляльности ионов,
m(Kν+Aν–) – моляльность недиссоциированных молекул,
m0 – моляльность раствора при расчете на полностью недиссоциированное вещество,
α – степень диссоциации – доля диссоциированных молекул,
КД – практическая константа диссоциации.
4 Коэффициент Вант-Гоффа i – изотонический коэффициент – связан со степенью электролитической диссоциации. i – среднее суммарное число частиц (ионов и молекул), образующихся при диссоциации одной молекулы
i = ν + α + ν- α + (1-α) = 1 + (ν++ν–-1)α = 1 + (ν – 1)α i = 1+(ν-1)α
По мере увеличения разведения коэффициент Вант-Гоффа приближается к простому целому числу (2,3,4 – в зависимости от числа ионов, образующихся при растворении молекул вещества):
Причины электролитической диссоциации
Твердые вещества, при растворении которых в воде и полярных растворителях, образуются электролиты, имеют, как правило, ионные или близкие к ним кристаллические решетки. При переходе ионов в раствор энергия электролитического взаимодействия ионов в решетке противопоставляется энергии взаимодействия ионов с дипольными молекулами растворителя, который втягивает ионы в раствор. При этом ионы окружаются молекулами растворителя, образующими вокруг ионов сольватную оболочку.
Если энергия взаимодействия ионов с растворителем становится соизмеримой с энергией ионов, колеблющихся около состояния равновесия в кристаллической решетке, то происходит растворение с диссоциацией.
Взаимодействие дипольных молекул растворителя с элементами кристаллической решетки может привести к образованию электролита даже при растворении веществ, имеющих молекулярную решетку, решетку промежуточного типа или находящихся в газообразном состоянии.
Таким образом, в осуществлении электролитической диссоциации определяющую роль играет взаимодействие ионов с растворителем.
Вода (ε291 = 81), а также HCN (ε298 = 107) и НСООН (ε298 = 57) относятся к растворителям, вызывающим сильную диссоциацию. Низшие спирты и кетоны, уксусная кислота, пиридин имеют ε = 20-35 и также способны образовывать электролиты, хотя и в меньшей степени, чем вода (ε – диэлектрическая проницаемость растворителя).
Из сказанного выше следует, что степень электролитической диссоциации (глубина процесса диссоциации) зависит от:
- типа кристаллической решетки растворенного вещества;
- диэлектрической проницаемости растворителя;
-
концентрации электролита (из уравнения
(*) следует, что
 при 1-α →1);
при 1-α →1);
- температуры (степень диссоциации при эндотермическом процессе с ростом температуры возрастает).
Недостатки теории Аррениуса
В теории электролитов очень важным является вопрос о распределении ионов в растворе. Распределение ионов определяется соотношением энергии электролитического взаимодействия и энергии хаотического (теплового) движения ионов. Оказывается, что эти энергии сравнимы по величине, поэтому реальное распределение ионов в электролите является промежуточным между упорядоченным и беспорядочным.
Электролитические силы стремятся установить такое распределение, при котором каждый ион окружен только ионами противоположного знака, но этому противодействует хаотическое движение ионов, приводящее к беспорядочному распределению. Эти противоположные тенденции приводят к тому, что около каждого иона образуется своеобразная ионная атмосфера, в которой преобладают ионы противоположного (по сравнению с центральным ионом) знака.
Аррениус предполагал, что взаимодействие ионов в растворе не влияет на их распределение и движение, которые остаются хаотическими, как и в смесях идеальных газов.
Аррениус утверждал, что свойства отдельных ионов не зависят от концентрации, а некоторые свойства раствора в целом, например электропроводность, пропорциональны числу ионов. Согласно этим представлениям подвижность ионов не должна зависеть от концентрации раствора, а электропроводность сильного электролита должна возрастать с увеличением концентрации раствора. Это противоречит экспериментальным данным.
По теории Аррениуса при m = 0,01 – 0,1 степень диссоциации сильных электролитов α = 0,75 – 0,95. Вычисляемые отсюда КД зависят от концентрации, то есть не являются константами. В действительности степень диссоциации сильных электролитов α→1, причем они диссоциируют необратимо. Экспериментально установлено, что недиссоциированных молекул в растворах сильных электролитов нет. Таким образом, теория Аррениуса не предусматривала деление электролитов на сильные и слабые.
Вывод:
Классическая теория Аррениуса применима к слабым электролитам (α ≤ 0,05).
СВ - Вода – не единственный ионизирующий агент. Электропроводность имеет место в многих неводных растворителях: спиртах, жидких CS2, H2S, H2F2 и даже в углеводородах. Процесс электролитической диссоциации невозможен без взаимодействия растворенного вещества с растворителем (сольватации). Ионизирующая активность определяется природой и свойствами растворителя. Важнейшими характеристиками растворителя как ионизирующего агента являются:
– способность его молекул вступать во взаимодействие с растворенным веществом, или способность сольватировать растворенные вещества;
– диэлектрическая проницаемость растворителя
– способность к собственной ионизации
Ионы в растворе образуются за счет:
– диссоциации растворенного вещества (NaCl, KCl);
– самоионизации растворителя
2H2O = H3O+ + OH-; 2NH3 = NH4+ + NH2-;
– взаимодействия растворителя и растворенного вещества
NH3 + H2O = NH3 ⋅ H2O = NH4+ + OH-;
Cl2 + H2O = HCl + HClO = H+ + Cl- + ClO-;
