
- •Вопрос 1),2),3): основные законы химии – сохранения массы, энергии, постоянства состава, Авогадро.
- •Вопрос 4): основные классы неорганических соединений.
- •Вопрос 5): Модель строения атома Резерфорда.
- •Вопрос 6): теория строения атома Бора. Недостатки этой теории.
- •Вопрос 7): принципы квантовой механики: дискретность энергии, корпускулярно-волновой дуализм, принцип неопределенности Гейзенберга.
- •Вопрос 8): уравнение Шредингера, основные идеи положенные в его основу. Смысл волновой функции.
- •Вопрос 9): Квантовые числа их значение и сущность.
- •Вопрос 10): понятие электронного уровня, подуровня, орбитали.
- •Вопрос 11): правила заполнения электронных уровней и подуровней.
- •Вопрос 12): s-,d-,p-,f-элементы. Положение в периодической системе и особенности электронного строения их атомов.
- •Вопрос 13): Закон Менделеева. Периодичность заряда и тд.
- •Вопрос 15),16),17),18),19),20),21),22),23): химическая связь. Виды хим. Связи. Энерг. Характеристики хим. Связи.
- •Вопрос 24): метод молекулярных орбиталей. Основные понятия.
- •Вопрос 25): описать методом мо некоторые соединения
- •Вопрос 26): Ионная связь, ее св-ва. Основные виды кристаллических решеток.
- •Вопрос 27): металлическая связь.
- •Вопрос 28): межмолекулярное взаимодействие. Оринетационный, индукционный и дисперсионный моменты.
- •Вопрос 29): водородная связь.
- •Вопрос 30): основные типы крист. Решеток.
- •Вопрос 31): основные законы термохимии. Следствия из законов Гесса.
- •Вопрос 32): внутренняя энергия системы, понятие энтальпии и энтропии.
- •Вопрос 33): энергия Гиббса, анализ уравнения Гиббса.
- •Вопрос 34): скорость химических реакций. Следствия из законов Гесса.
- •Вопрос 34),35): факторы, влияющие на скорость хим. Реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •Вопрос 37): гетерогенные реакции. Влиянии диффузии и степени дискретности.
- •Вопрос 38): влияние катализатора. Причины влияние катализатора.
- •Вопрос 39): обратимые процессы. Хим. Равновесие. Константа равновесия.
- •Вопрос 40): влияние различных факторов на смещение равновесия. Принцип Ле-Шателье.
- •Вопрос 41): определение раствора. Физико-химические процессы при образовании раствора. Энтальпия и энтропия при растворении.
- •Вопрос 42): способы выражения концентрации раствора.
- •Вопрос 43): закон Рауля.
- •Вопрос 44): Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •Вопрос 45): раствор электролитов. Сильные и слабые электролиты. Степень диссоциации. Изотонический коэффициент.
- •Вопрос 46): теория электролитической диссоциации. Физическая Аррениуса, Химическая Менделеева и современный взгляд на диссоциацию.
- •Вопрос 47): Реакция в растворах электролитов, их направленность, смещение равновесия.
- •Вопрос 48): ионное произведение воды. Водородный показатель.
- •Вопрос 49): гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •Вопрос 50): Гидролиз соли и все что с ним связано.
- •Вопрос 51): Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •Вопрос 53): Гальванические элементы; процессы на электродах; эдс гальванического элемента:
- •Вопрос 54): Обратимые источники электрической энергии; кислотные и щелочные аккумуляторы:
- •Вопрос 55): Топливные элементы:
- •Вопрос 56): Электролиз растворов и расплавов; последовательность электродных процессов; перенапряжение и поляризация:
- •Вопрос 59): Применение электролиза в промышленности:
- •Вопрос 60): Электрохимическая коррозия металлов; основные виды электрохимической коррозии; процессы на электродах
- •Вопрос 61): Методы борьбы с коррозией
Вопрос 39): обратимые процессы. Хим. Равновесие. Константа равновесия.
Х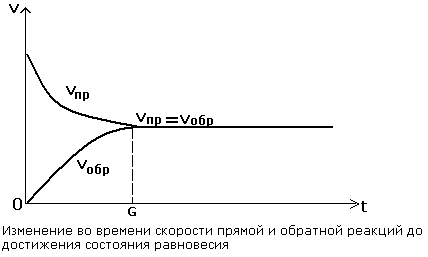 имические
реакции заключаются во взаимодействии
реагентов с образованием продуктов
реакциию. Не следует, однако, полагать,
что направление химической реакции
только одно. В действительности,
химические реакции протекают и в прямом,
и в обратном направлениях: реагенты↔продукты
имические
реакции заключаются во взаимодействии
реагентов с образованием продуктов
реакциию. Не следует, однако, полагать,
что направление химической реакции
только одно. В действительности,
химические реакции протекают и в прямом,
и в обратном направлениях: реагенты↔продукты
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. А2 + В2 ⇄ 2AB. Все химические реакции, в принципе, обратимы. Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением,концентрацией веществ). Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты. Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу: Fe+S↔FeS
Пример. Реакция синтеза аммиака является обратимой:N2+3H2↔2NH3
При 200 атм и 400 0С достигается максимальное и равное 36% (по объему) содержание NH3 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается. Прямая и обратная реакции протекают одновременно в противоположных направлениях.
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия.
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Константа
равновесия.
Важнейший
параметр, характеризующий обратимую
химическую реакцию это константа
равновесия К.
Если записать для рассмотренной обратимой
реакции A + D
![]() C
+ D условие равенства скоростей прямой
и обратной реакции в состоянии равновесия
– k1[A]равн[B]равн
= k2[C]равн[D]равн,
откуда [C]равн[D]равн/[A]равн[B]равн
= k1/k2
= К,
то величина
К называется
константой равновесия химической
реакции.
C
+ D условие равенства скоростей прямой
и обратной реакции в состоянии равновесия
– k1[A]равн[B]равн
= k2[C]равн[D]равн,
откуда [C]равн[D]равн/[A]равн[B]равн
= k1/k2
= К,
то величина
К называется
константой равновесия химической
реакции.
Итак, при равновесии отношение концентрации продуктов реакции к произведению концентрации реагентов постоянно, если постоянна температура (константы скорости k1 и k2 и, следовательно, константа равновесия К зависят от температуры, но не зависят от концентрации реагентов). Если в реакции участвуют несколько молекул исходных веществ и образуется несколько молекул продукта (или продуктов), концентрации веществ в выражении для константы равновесия возводятся в степени, соответствующие их стехиометрическим коэффициентам. Так для реакции 3H2 + N2 2NH3 выражение для константы равновесия записывается в виде K = [NH3]2 равн/[H2]3равн[N2]равн. Описанный способ вывода константы равновесия, основанный на скоростях прямой и обратной реакций, в общем случае использовать нельзя, так как для сложных реакций зависимость скорости от концентрации обычно не выражается простым уравнением или вообще неизвестна. Тем не менее, в термодинамике доказывается, что конечная формула для константы равновесия оказывается верной.
Для газообразных соединений вместо концентраций при записи константы равновесия можно использовать давление. Тогда К= парциальное давление продукта (произведение если несколько)/парциальное давление реагента (произведение если несколько), парциальные давления возводятся в степени коэффициентов между веществами.
