
- •Вопрос 1),2),3): основные законы химии – сохранения массы, энергии, постоянства состава, Авогадро.
- •Вопрос 4): основные классы неорганических соединений.
- •Вопрос 5): Модель строения атома Резерфорда.
- •Вопрос 6): теория строения атома Бора. Недостатки этой теории.
- •Вопрос 7): принципы квантовой механики: дискретность энергии, корпускулярно-волновой дуализм, принцип неопределенности Гейзенберга.
- •Вопрос 8): уравнение Шредингера, основные идеи положенные в его основу. Смысл волновой функции.
- •Вопрос 9): Квантовые числа их значение и сущность.
- •Вопрос 10): понятие электронного уровня, подуровня, орбитали.
- •Вопрос 11): правила заполнения электронных уровней и подуровней.
- •Вопрос 12): s-,d-,p-,f-элементы. Положение в периодической системе и особенности электронного строения их атомов.
- •Вопрос 13): Закон Менделеева. Периодичность заряда и тд.
- •Вопрос 15),16),17),18),19),20),21),22),23): химическая связь. Виды хим. Связи. Энерг. Характеристики хим. Связи.
- •Вопрос 24): метод молекулярных орбиталей. Основные понятия.
- •Вопрос 25): описать методом мо некоторые соединения
- •Вопрос 26): Ионная связь, ее св-ва. Основные виды кристаллических решеток.
- •Вопрос 27): металлическая связь.
- •Вопрос 28): межмолекулярное взаимодействие. Оринетационный, индукционный и дисперсионный моменты.
- •Вопрос 29): водородная связь.
- •Вопрос 30): основные типы крист. Решеток.
- •Вопрос 31): основные законы термохимии. Следствия из законов Гесса.
- •Вопрос 32): внутренняя энергия системы, понятие энтальпии и энтропии.
- •Вопрос 33): энергия Гиббса, анализ уравнения Гиббса.
- •Вопрос 34): скорость химических реакций. Следствия из законов Гесса.
- •Вопрос 34),35): факторы, влияющие на скорость хим. Реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •Вопрос 37): гетерогенные реакции. Влиянии диффузии и степени дискретности.
- •Вопрос 38): влияние катализатора. Причины влияние катализатора.
- •Вопрос 39): обратимые процессы. Хим. Равновесие. Константа равновесия.
- •Вопрос 40): влияние различных факторов на смещение равновесия. Принцип Ле-Шателье.
- •Вопрос 41): определение раствора. Физико-химические процессы при образовании раствора. Энтальпия и энтропия при растворении.
- •Вопрос 42): способы выражения концентрации раствора.
- •Вопрос 43): закон Рауля.
- •Вопрос 44): Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •Вопрос 45): раствор электролитов. Сильные и слабые электролиты. Степень диссоциации. Изотонический коэффициент.
- •Вопрос 46): теория электролитической диссоциации. Физическая Аррениуса, Химическая Менделеева и современный взгляд на диссоциацию.
- •Вопрос 47): Реакция в растворах электролитов, их направленность, смещение равновесия.
- •Вопрос 48): ионное произведение воды. Водородный показатель.
- •Вопрос 49): гетерогенные равновесия в растворах электролитов. Произведение растворимости.
- •Вопрос 50): Гидролиз соли и все что с ним связано.
- •Вопрос 51): Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •Вопрос 53): Гальванические элементы; процессы на электродах; эдс гальванического элемента:
- •Вопрос 54): Обратимые источники электрической энергии; кислотные и щелочные аккумуляторы:
- •Вопрос 55): Топливные элементы:
- •Вопрос 56): Электролиз растворов и расплавов; последовательность электродных процессов; перенапряжение и поляризация:
- •Вопрос 59): Применение электролиза в промышленности:
- •Вопрос 60): Электрохимическая коррозия металлов; основные виды электрохимической коррозии; процессы на электродах
- •Вопрос 61): Методы борьбы с коррозией
Вопрос 33): энергия Гиббса, анализ уравнения Гиббса.
СэГ - это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида: G=U+pV-TS, dG=dH-TdS.
(dH<0,dS>0 – dG<0) – реакция самопроизв., (dH>0,dS<0 – dG<0) – реакция не идет, (dH<0,dS<0 – dG<0) – реакция идет T<<, (dH>0,dS>0 – dG<0) – реакция идет Т>>.
Существует
полезное соотношение, связывающее
изменение свободной энергии Гиббса ![]() в
ходе химической реакции с её константой
равновесия
в
ходе химической реакции с её константой
равновесия ![]() :
:
![]()
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
![]()
где ![]() — константа
скорости прямой
реакции,
— константа
скорости прямой
реакции, ![]() —
константа скорости обратной реакции
—
константа скорости обратной реакции
Вопрос 34): скорость химических реакций. Следствия из законов Гесса.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам.
Закон действующих масс – 2A+3B=4D+5C -> Vпрямой=Кпрямой*[A]^2*[B]^3, Vобратной=Кобратной*[D]^4*[C]^5.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Вопрос 34),35): факторы, влияющие на скорость хим. Реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
Факторы: 1) концентрация, влияние из ЗДМ – 2A+3B=4D+5C -> Vпрямой=Кпрямой*[A]^2*[B]^3, Vобратной=Кобратной*[D]^4*[C]^5 2) дисперсность в гетер. Реакциях 3) агрегатное состояние – если вещества в одном агр. состоянии (жидком) реакция идет быстрее (взаимодействие по всему объему) 4) давление (парциальное) – O2 + 2CO -> 2CO2 Vпрямой= Kпрямой*Po2*Pco^2, Vобратной=Кобратной*Pco2^2 5) температура – Уравнение Fррениуса: К= А(число эл. Соударений)*exp(-Ea/(R*T)), правило Вант-Гоффа V2=V1*коэф(2-4)^(dT/10)
Энергия активации (Ea) - минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоуляхна моль), чтобы произошла реакция. Частицы, обладающие таким и большим запасом энергии, называют активными. Например, для зажигания спички ее предварительно нагревают посредством трения, а для зажигания смеси бензина с воздухом в автомобильном двигателе используется энергия искры. Активные частицы могут образовать при столкновении промежуточную неустойчивую группировку, находящуюся в состоянии перераспределения связей, называемую активированный комплекс, при дальнейшем превращении которого образуются продукты реакции (теория активации Аррениуса).
Э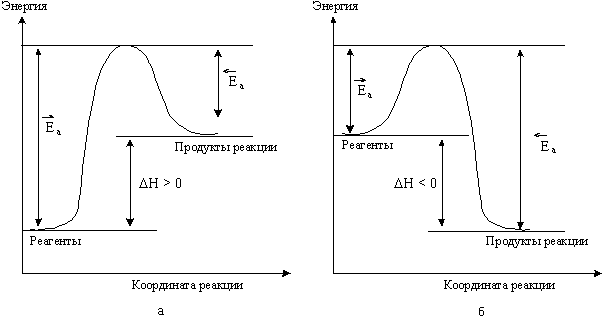 нергию
активации можно рассматривать как некую
пороговую энергию, которую должны
приобрести молекулы реагентов, чтобы
преодолеть определенный энергетический
барьер. Таким
образом, Еа
равна разности между средней энергией
реагирующих частиц и энергией
активированного комплекса. Еа
определяется
природой реагентов.
Значение Еа
колеблется в пределах от 0 до 400 кДж. Если
значение Еа
превышает 150 кДж, то такие реакции при
температурах, близких к стандартной,
не протекают. Влияние температуры на
скорость реакции тем сильнее, чем больше
величина Еа.
Реакции с высокими Еа
при низких температурах протекают с
малыми скоростями, однако, влияние
температуры на скорость таких реакций
более значительно. Схема, приведенная
на рис 5.5, поясняет эти представления.
нергию
активации можно рассматривать как некую
пороговую энергию, которую должны
приобрести молекулы реагентов, чтобы
преодолеть определенный энергетический
барьер. Таким
образом, Еа
равна разности между средней энергией
реагирующих частиц и энергией
активированного комплекса. Еа
определяется
природой реагентов.
Значение Еа
колеблется в пределах от 0 до 400 кДж. Если
значение Еа
превышает 150 кДж, то такие реакции при
температурах, близких к стандартной,
не протекают. Влияние температуры на
скорость реакции тем сильнее, чем больше
величина Еа.
Реакции с высокими Еа
при низких температурах протекают с
малыми скоростями, однако, влияние
температуры на скорость таких реакций
более значительно. Схема, приведенная
на рис 5.5, поясняет эти представления.
Уравнение
Аррениуса
устанавливает зависимость константы
скорости химической
реакции
![]() от
температуры
от
температуры
![]() .
.
Согласно
простой модели столкновений химическая
реакция между двумя исходными веществами
может происходить только в результате
столкновения молекул
этих веществ. Но не каждое столкновение
ведёт к химической реакции. Необходимо
преодолеть определённый энергетический
барьер, чтобы молекулы начали друг с
другом реагировать. То есть молекулы
должны обладать некой минимальной
энергией (энергия активации
![]() ),
чтобы этот барьер преодолеть. Из
распределения
Больцмана
для кинетической энергии молекул
известно, что число молекул, обладающих
энергией
),
чтобы этот барьер преодолеть. Из
распределения
Больцмана
для кинетической энергии молекул
известно, что число молекул, обладающих
энергией
![]() ,
пропорционально
,
пропорционально
![]() .
В результате скорость химической реакции
представляется уравнением, которое
было получено шведским химиком Сванте
Аррениусом
из термодинамических соображений:
.
В результате скорость химической реакции
представляется уравнением, которое
было получено шведским химиком Сванте
Аррениусом
из термодинамических соображений:![]()
Здесь
![]() характеризует
частоту столкновений реагирующих
молекул,
характеризует
частоту столкновений реагирующих
молекул,
Правило Вант-Гоффа — при повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два-четыре раза.
Уравнение, которое описывает это правило, следующее:
![]()
где ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
