- •Основные понятия органической химии
- •Классификация органических соединений
- •Гомология
- •Изомерия
- •Номенклатура алканов
- •Строение алканов
- •Физические свойства алканов
- •Химические свойства алканов
- •Промышленные методы получения алканов
- •Лабораторные методы получения алканов
- •Номенклатура алкенов
- •Строение алкенов
- •Физические свойства алкенов
- •Химические свойства алкенов
- •3) Реакции полимеризации:
- •5) Неполное окисление.
- •Промышленные методы получения алкенов
- •Диеновые углеводороды
- •Ароматические углеводороды (арены)
- •Физические свойства главных представителей ароматических углеводородов.
- •Нефть и ее переработка
- •Пример:
- •Гидроксильные производные углеводородов Определение: в молекуле гидроксилпроизводного один или несколько атомов водорода замещены на гидроксильную (он) группу.
- •Карбонильные соединения
- •Карбоновые кислоты Определение: в молекуле карбоновой кислоты содержится группа -соон (карбоксильная группа).
- •Монокарбоновые кислоты
- •Дисахариды
- •Полисахариды
- •Амины Определение: амины – это производные аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы (r).
- •Аминокислоты в состав молекул аминокислот входит две функциональные группы: карбоксильная –соон и аминогруппа –nh2.
- •Химические волокна
Ароматические углеводороды (арены)
Общая формула ароматических углеводородов ряда бензола СnH2n-6 , где n6
Названия ароматических углеводородов по систематической номенклатуре IUPAC – в основе лежит название простейшего представителя – бензола: |
|
Нумерация атомов бензольного ядра (при наличии двух и более заместителей):
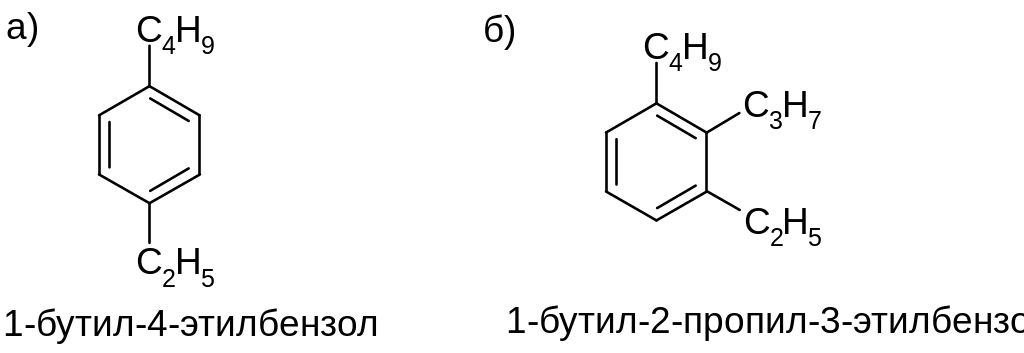
Если при нумерации ди- (и более) замещенного бензола существует выбор между несколькими возможностями с одинаковым набором локантов, то первый номер получает группа, идущая впереди в алфавите.
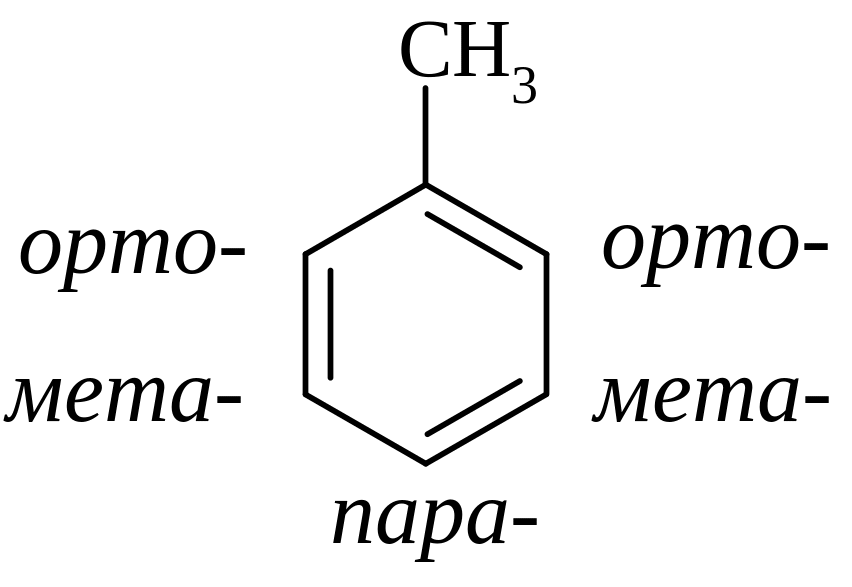
Использование специальных префиксов: орто-, мета- и пара- (сокращенно: о-, м-, п-) для обозначения относительного расположения заместителей:
Устоявшиеся тривиальные названия, применяемые для ароматических углеводородов бензольного ряда (разрешены в правилах IUPAC):
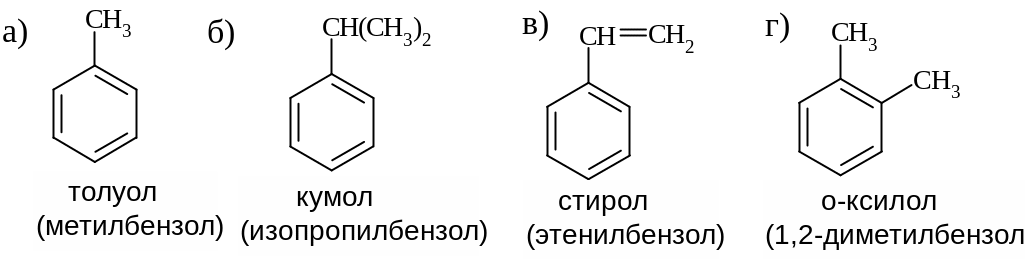
Фенильной группой называют группу С6Н5, образующуюся при удалении атома водорода от одного из С-атомов молекулы бензола.
Физические свойства главных представителей ароматических углеводородов.
Бензол и его низшие гомологи характеризуются сильным, довольно приятным ароматическим запахом10. Они легче воды и очень плохо в ней растворяются. Ароматические углеводороды сильно токсичны и продолжительное вдыхание их паров опасно!
Примечательно, что, если температуры кипения алкилбензолов с ростом молекулярной массы более или менее плавно возрастают, то для температур плавления четко прослеживается связь с симметричностью молекулы. Так, температура кипения толуола С7Н8 (110.6 С) выше, чем бензола С6Н6 (80.1 С), в то время как температура плавления более симметричного бензола (5.4 С) гораздо выше температуры плавления толуола (-93 С). Аналогичная закономерность наблюдается и в ряду изомерных ксилолов.
Строение молекулы бензола
В 1865 г немецкий химик Ф. А. Кекуле предложил для бензола формулу 1,3,5-циклогексатриена. По данным современных физико-химических методов, бензол представляет собой правильный шестиугольник с длиной С-С связи 0.140 нм и валентными углами 120о. Другими словами, все С-С связи в молекуле бензола равноценны и по своей длине занимают промежуточное значение между одинарной и двойной связями. Причина – сопряжение трех -связей, в результате которого образуется замкнутая -электронная система. Связи в бензоле размазаны, делокализованы, и именно образующийся так называемый секстет11 -электронов обусловливает особые, "ароматические" свойства бензола.
Ароматичность
В настоящее время под ароматичностью понимают совокупность специфических свойств плоской сопряженной циклической системы, имеющей замкнутую электронную оболочку: они более стабильны, чем непредельные углеводороды, и склонны реагировать с сохранением сопряженной циклической (ароматической) системы.
Для того чтобы подчеркнуть особый, "ароматический" характер -связей в бензоле, их часто обозначают сплошным или пунктирным кольцом: |
|
Наряду с этой формулой, широко используется и формула Кекуле, при этом имеется в виду, что свойства изображаемых в ней двойных и простых связей иные, чем в непредельных соединениях.
Химические свойства ароматических углеводородов.
Реакции электрофильного замещения. Ароматические соединения, хотя и являются сильно ненасыщенными, но не вступают в характерные для других ненасыщенных соединений (например, алкенов) реакции присоединения. Так, бензол не обесцвечивает бромную воду, не изменяет окраски калий-перманганата. Наиболее характерными для бензола являются реакции электрофильного12 замещения в ароматическом ядре, поскольку они протекают с сохранением устойчивой ароматической системы.
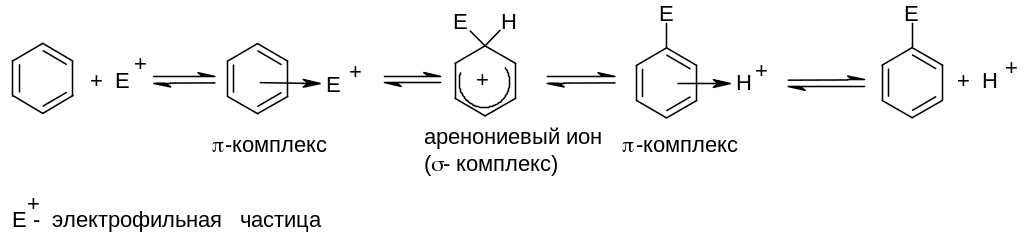
Обобщенный механизм реакций электрофильного замещения
Первоначально бензол образует с электрофильным реагентом p-комплекс, в котором нет направленной связи между электрофилом и каким-нибудь конкретным атомом углерода бензольного кольца, а реализуется донорно-акцепторное взаимодействие электронной p-системы бензола в целом как донора и электрофила как акцептора. Далее за счет электронной пары одной из p-связей бензола происходит образование s-связи между атомом углерода бензольного кольца и электрофилом. На этой стадии атом, образующий связь с электрофилом, переходит из sp2-гибридного состояния в sp3-гибридное. При этом ароматическая система разрушается, и бензольное кольцо приобретает положительный заряд. Образующаяся частица называется аренониевым ионом, или s-комплексом, положительный заряд в нем делокализован по кольцу (делокализация показана с помощью пунктирной линии). Завершает реакцию отщепление протона от -комплекса, в результате которого восстанавливается разрушенная на предыдущей стадии ароматическая система:
Реакции электрофильного замещения обычно проводят в присутствие катализаторов, роль которых – повышение активности (электрофильности) реагента.
Наиболее важные реакции.
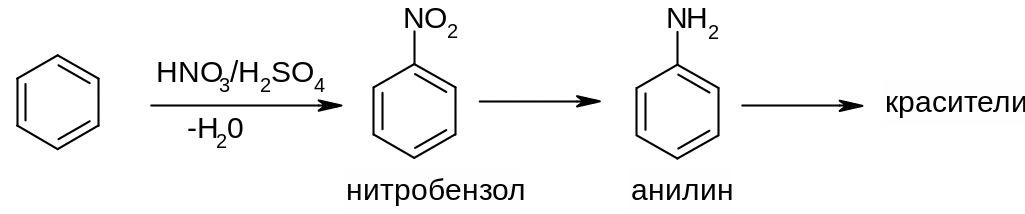
а) Реакция нитрования. Проводят, действуя на бензол смесью концентрированных азотной и серной кислот (нитрующей смесью). Серная кислота – катализатор процесса:
Применение реакции:
А) Продукт нитрования бензола – нитробензол – восстанавливают до анилина, являющегося исходным сырьем в производстве красителей.
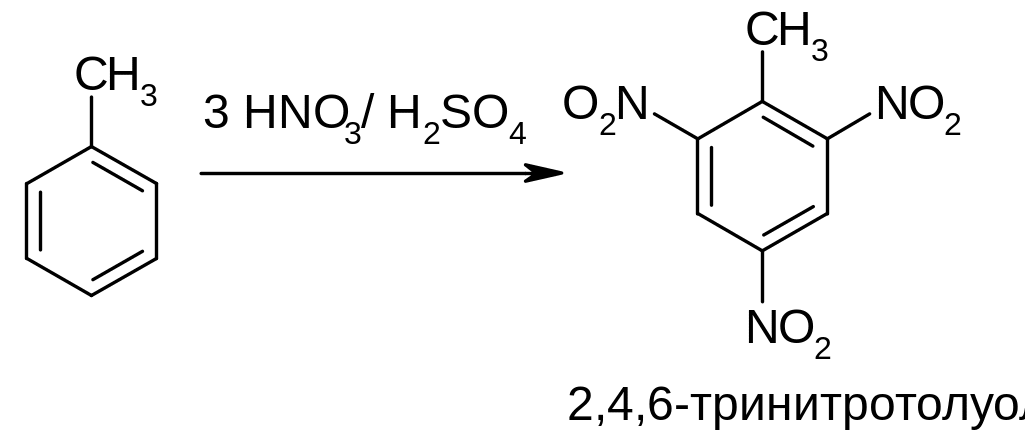
Б) Нитрованием толуола получают 2,4,6-тринитротолуол - используется как взрывчатое вещество (тротил, тол):
б) реакции бромирования и хлорирования. Проводят в присутствии катализаторов, например галогенидов алюминия или железа, роль которых - активация молекулы галогена. Реакцию бромирования обычно осуществляют действием брома в присутствии железных стружек: железо реагирует с бромом с образованием катализатора –железо(III)-бромида.
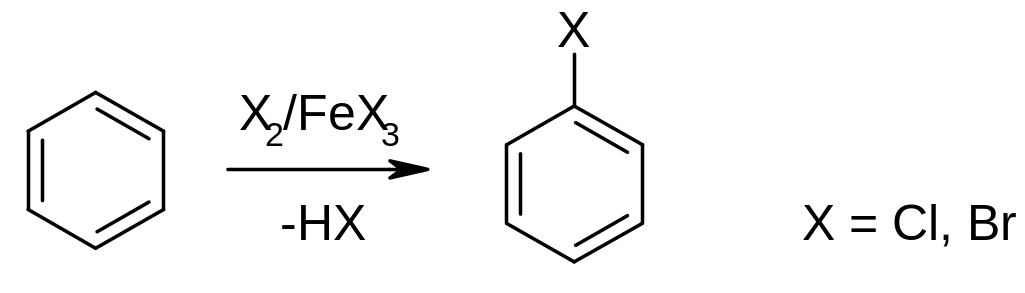
Применение реакции: в промышленных и лабораторных синтезах.
В) Реакция алкилирования. В качестве источников алкильных групп используют галогеналканы, спирты или алкены. Реакции проводят в присутствии протонных кислот или кислот Льюиса (катализаторы), таких как HCl-AlCl3; HF или HF-BF3; H3PO4.
Алкилирование бензола алкенами широко используется в промышленности.
Примеры:
1)
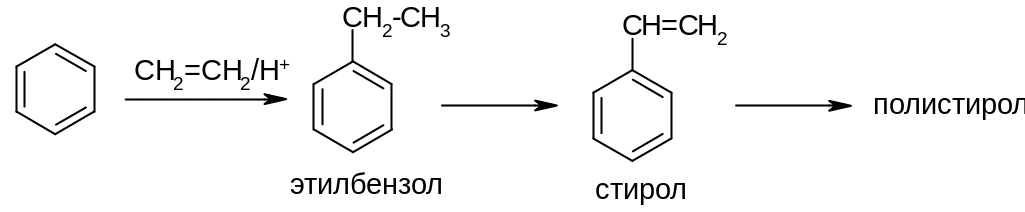
Применение реакции: дегидрированием этилбензола получают важный мономер стирол.
2)
В данной реакции образуется связь с участием С-2 атома молекулы пропена (продукт – изопропилбензол), что обусловлено теми же факторами, что и направление реакции электрофильного присоединения к алкенам: кислота протонирует двойную связь алкена с образованием более устойчивого из двух возможных (вторичного) карбокатиона:
![]()
который далее атакует бензольное кольцо, давая после отщепления протона изопропилбензол.
Применение реакции: кумольный метод получения фенола (второй важный продукт – ацетон).
Алкилирование галогеналканами или спиртами: особенностью реакции является изомеризация алкилирующего агента в ходе реакции, в результате чего наблюдается образование смеси изомерных продуктов.
Пример:
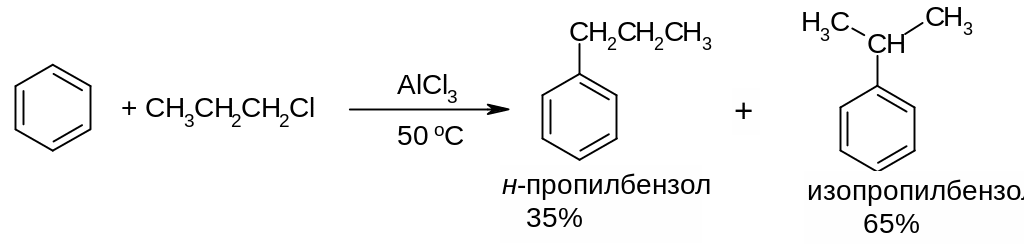
В) Реакция ацилирования. В качестве источников ацильных групп используют галогенангидриды RCOCl или ангидриды (RCO)2O карбоновых кислот в присутствии хлорида алюминия (катализатор):
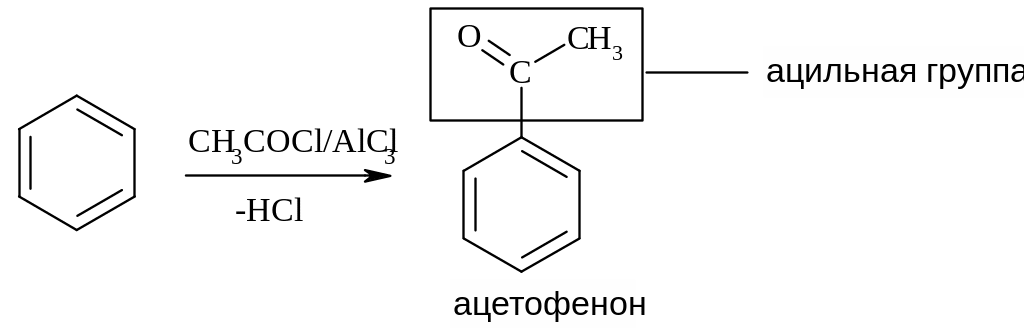
Следует обратить внимание, что при использовании ангидридов в ходе реакции ацилирования выделяется карбоновая кислота RCOOН, что ведет к потере одного моля карбоновой кислоты и ограничивает широкое использование ангидридов в реакциях ацилирования. Широко используется лишь доступный уксусный ангидрид13:
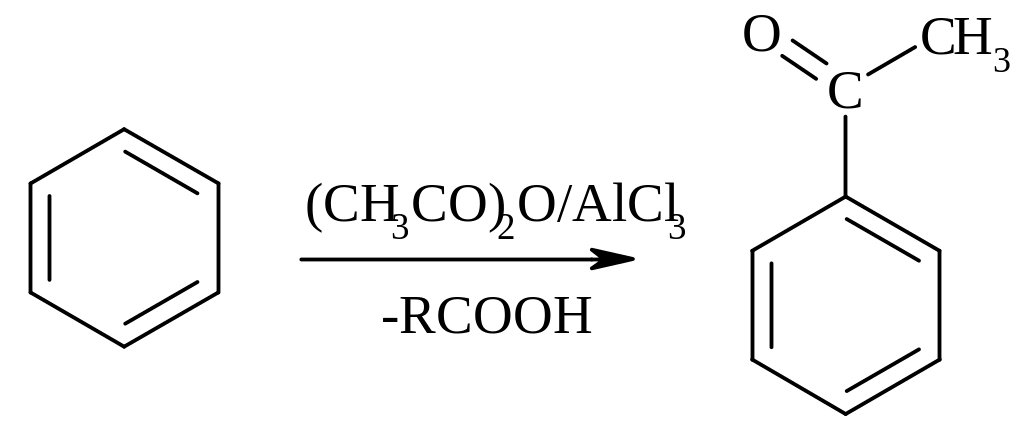
Применение реакции: ацетофенон – душистое вещество (применяют для отдушки мыла).
1) Реакции присоединения к двойным связям бензольного кольца. Протекают с разрушением ароматической системы.
А) гидрирование бензола. Бензол гидрируется труднее, чем алкены. Для осуществления этой реакции требуются повышенные температура и давление. В реакции удается выделить только конечный продукт гидрирования – циклогексан. Выделить промежуточные продукты (циклогексадиен, циклогексен) не удается, так как они гидрируются быстрее, чем бензол):

Применение реакции: в производстве волокна капрон.
Б) Присоединение хлора. При действии на бензол хлора на свету энергетически выгоднее оказывается не реакция замещения атома водорода, а реакция присоединения хлора:

Применение реакции: образующийся гексахлорциклогексан (гексахлоран) – используется в сельском хозяйстве для борьбы с насекомыми-вредителями.
Реакции окисления алкилбензолов.
А) Толуол окисляется до бензойной кислоты под действием таких окислителей, как калий- перманганат, азотная кислота, кислород воздуха в присутствии катализаторов. Окисление до бензойной кислоты характерно и для других алкилбензолов, содержащих хотя бы один атом водорода в положении, соседнем с бензольным кольцом.
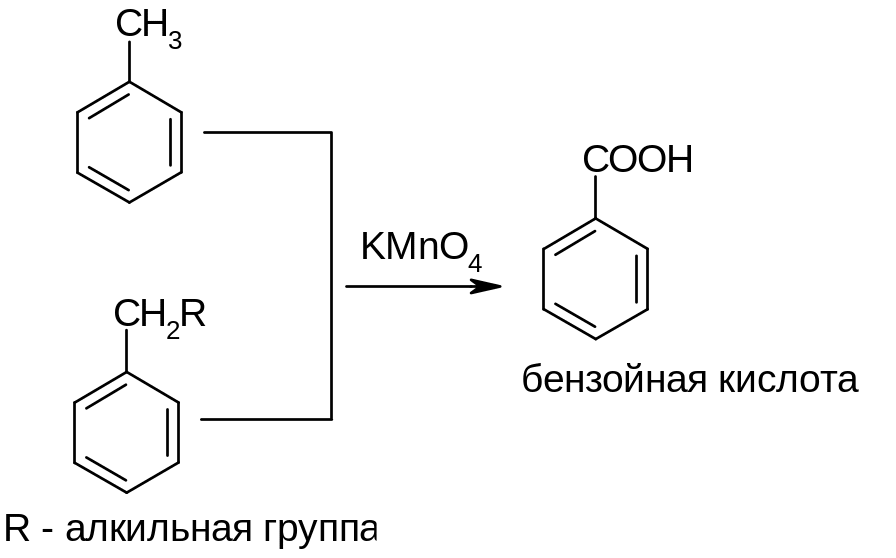
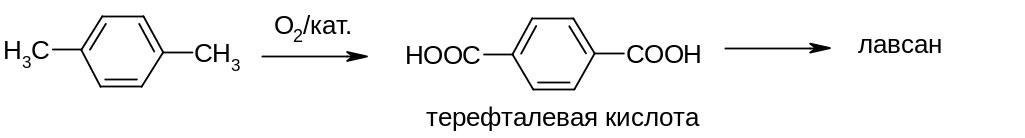
Применение реакции: окислением п-ксилола кислородом воздуха (катализатор – соль Co или Mn) получают терефталевую кислоту, которую используют в производстве волокна лавсан:
б) горение бензола: горит дымящим пламенем.
![]()
Применение реакции: в двигателях внутреннего сгорания. Добавки ароматических углеводородов повышают октановое число бензина.
Октановые числа некоторых ароматических углеводородов:
углеводород |
толуол |
этилбензол |
П-ксилол |
? |
|
Октановое число |
124 |
124 |
146 |
|
|
Промышленные методы получения аренов
1) Из нефти (риформинг). Так, С8-фракция прямой перегонки нефти, после проведения процесса риформинга, содержит примерно 20-24% о-ксилола, 42-48% м-ксилола, 16-20%
Из коксового газа. Коксование – это разложение при высоких температурах без доступа воздуха твердых и жидких горючих ископаемых с образованием летучих веществ и твердого остатка – кокса (от англ. coke). Летучие продукты разделяются на коксовый газ и жидкий конденсат.
Из коксового газа после охлаждения и дальнейшей обработки получают т. н. "сырой бензол", содержащий, кроме самого бензола, его ближайшие гомологи.
Жидкий конденсат в основном состоит из водного раствора аммиака и каменноугольной смолы - вязкой темной жидкости. Она содержит до десяти тысяч соединений ароматического ряда, из них выделено и охарактеризовано около 500 веществ, составляющих до 55% от общей массы смолы (причем до 10% приходится на нафталин).
Лабораторные методы получения аренов
Простейшие ароматические углеводороды являются продуктами крупнотоннажного промышленного производства, поэтому в лаборатории их не получают. Соединения же более сложного строения можно получить, используя следующие методы.
Из фенолов (восстановление):
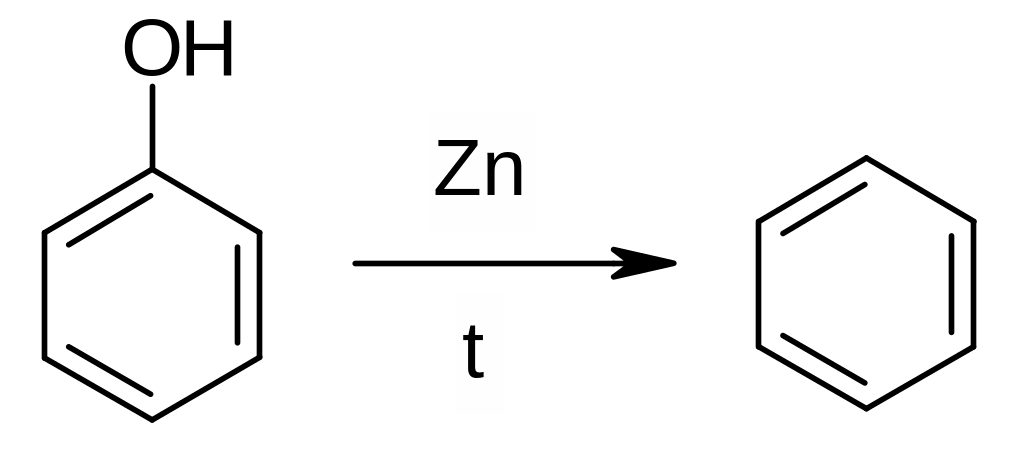
Из солей аренкарбоновых кислот (декарбоксилирование):
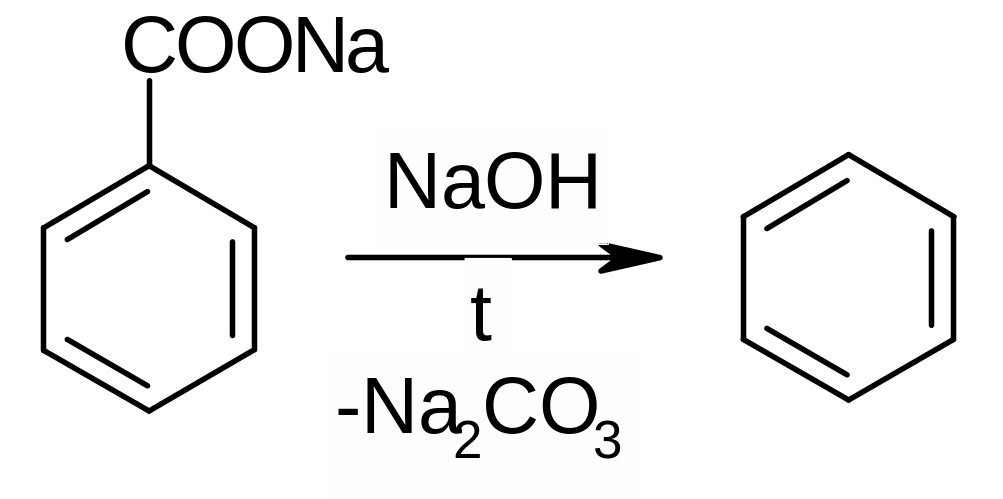
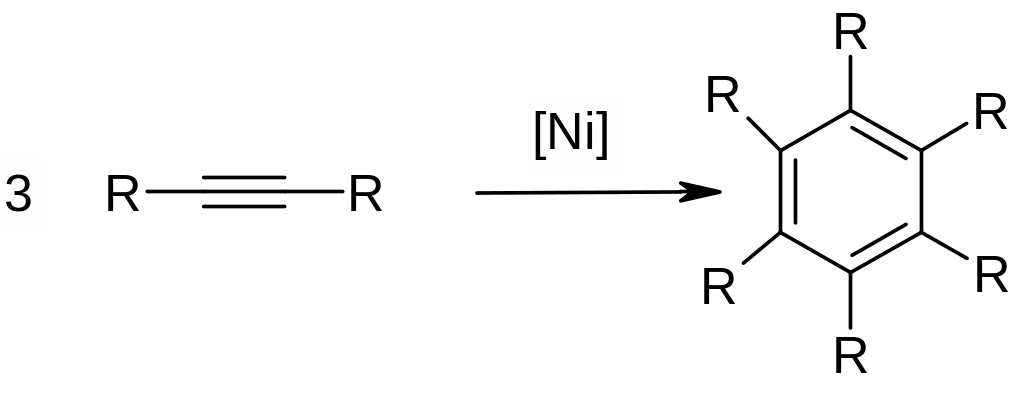
Из алкинов (циклотримеризация). Используют для синтеза замещенных бензолов: