- •Основные понятия органической химии
- •Классификация органических соединений
- •Гомология
- •Изомерия
- •Номенклатура алканов
- •Строение алканов
- •Физические свойства алканов
- •Химические свойства алканов
- •Промышленные методы получения алканов
- •Лабораторные методы получения алканов
- •Номенклатура алкенов
- •Строение алкенов
- •Физические свойства алкенов
- •Химические свойства алкенов
- •3) Реакции полимеризации:
- •5) Неполное окисление.
- •Промышленные методы получения алкенов
- •Диеновые углеводороды
- •Ароматические углеводороды (арены)
- •Физические свойства главных представителей ароматических углеводородов.
- •Нефть и ее переработка
- •Пример:
- •Гидроксильные производные углеводородов Определение: в молекуле гидроксилпроизводного один или несколько атомов водорода замещены на гидроксильную (он) группу.
- •Карбонильные соединения
- •Карбоновые кислоты Определение: в молекуле карбоновой кислоты содержится группа -соон (карбоксильная группа).
- •Монокарбоновые кислоты
- •Дисахариды
- •Полисахариды
- •Амины Определение: амины – это производные аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы (r).
- •Аминокислоты в состав молекул аминокислот входит две функциональные группы: карбоксильная –соон и аминогруппа –nh2.
- •Химические волокна
Промышленные методы получения алканов
Из природного газа (метан – содержание до 99%).
Из нефти (ректификация).
Гидрирование каменного или бурого угля (сжижение угля). Протекает при высоких температурах (450-470С) в присутствии катализатора (соединения молибдена, вольфрама, никеля). В результате получается жидкая смесь алканов и циклоалканов, которую используют в качестве моторного топлива.
Каталитическое гидрирование оксидов углерода на никелевом катализаторе дает метан:
![]()
![]()
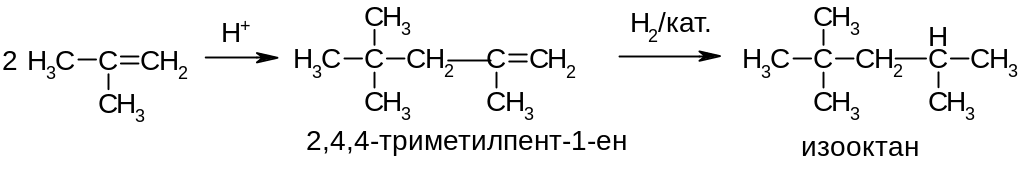
5) Гидрирование ненасыщенных соединений. Проводят в присутствие металлических катализаторов (Pd, Ni, Pt, Rh и др.). Пример: получение 2,2,4-триметилпентана (изооктана) – ценного моторного топлива:
Лабораторные методы получения алканов
1) Гидролиз карбида алюминия (получение метана): |
|
2) Щелочное плавление натриевых солей карбоновых кислот:
|
|
3) Синтез Вюрца (применяется для получения высших алканов симметричного строения): |
|
4) Восстановление галогеналканов: |
|
5) Гидрирование ненасыщенных соединений: |
|
Алкены
Общая формула СnH2n
Номенклатура алкенов
Наличие двойной связи обозначается заменой окончания "-ан" в названии соответствующего алкана на "-ен". Примеры: С2H4 – этен, С3H6 – пропен.
Выбор главной цепи: она должна включать двойную связь. Пример:
|
|
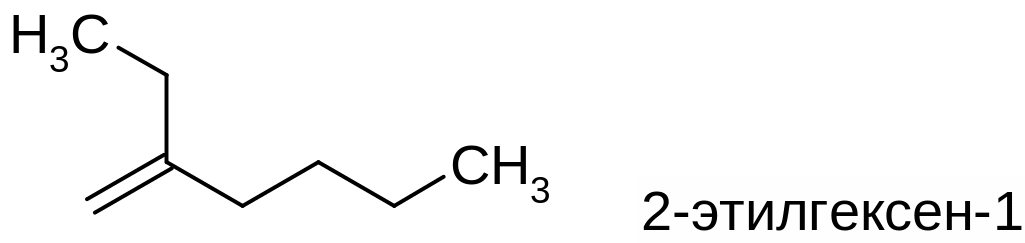
Нумерация цепи разветвленного алкена: двойная связь должна получить меньший номер, даже если заместители (алкильные группы) получат при этом больший из возможных номеров. Пример: |
|
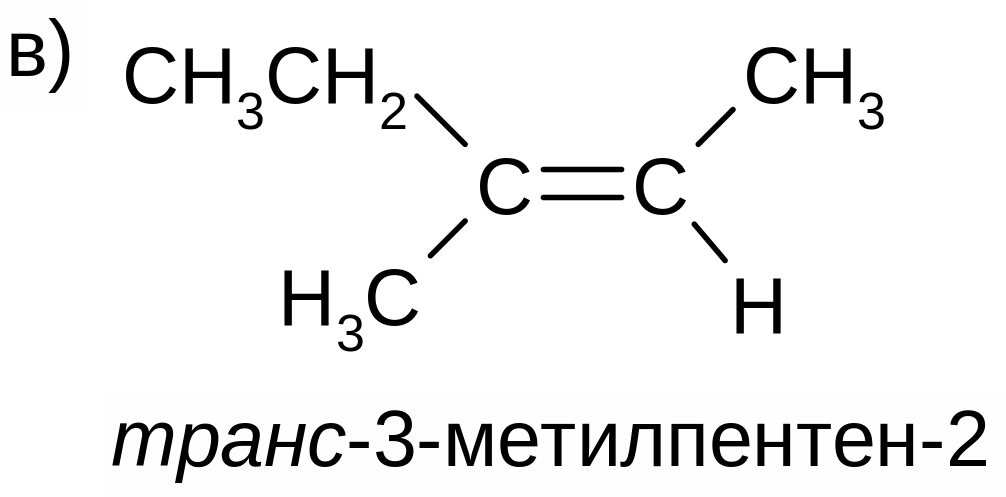
Цис-транс-номенклатура пространственных изомеров: в цис-изомере две одинаковые (или подобные) группы расположены по одну сторону от двойной связи, в транс-изомере – по разные. Примеры:
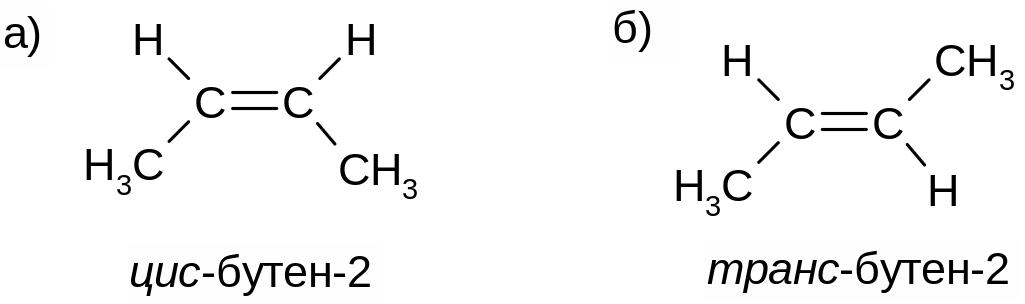
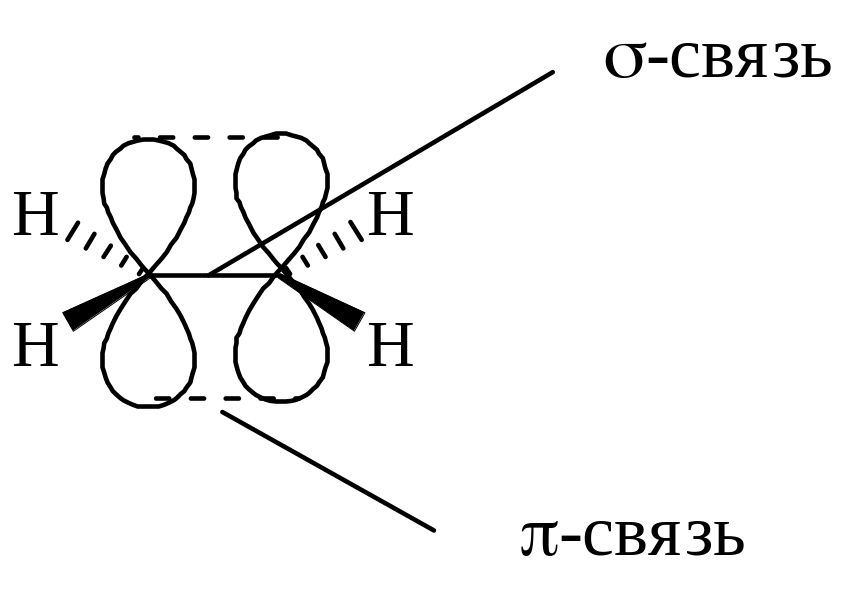
Строение алкенов
В молекуле этена есть два типа связей - s- и p-связи. Все s-связи2 лежат в одной плоскости, валентный угол между ними равен 120°. p-Связь образована двумя р-электронами, перекрывание электронных р-облаков осуществляется не по линии связи, а в двух областях пространства по обе стороны от нее: |
|
Следствие жесткости p-связи – возникновение пространственной изомерии.
Характеристики одинарных и двойных связей:
связь |
Длина связи, нм |
Энергия связи, кДж/моль |
С-С |
0,154 |
347 |
С=С |
0,133 |
612 |
p-Связь в молекуле алкена менее прочна, чем s-связь, поэтому для алкенов характерны реакции, в ходе которых происходит разрыв менее прочных p-связей и образование s-связей.
Физические свойства алкенов
По физическим свойствам ненасыщенные алифатические углеводороды мало отличаются от алканов. Температуры плавления и кипения алкенов несколько ниже, чем у соответствующих насыщенных углеводородов.

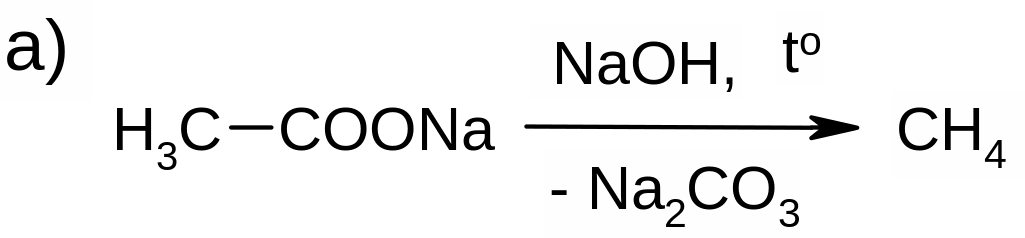
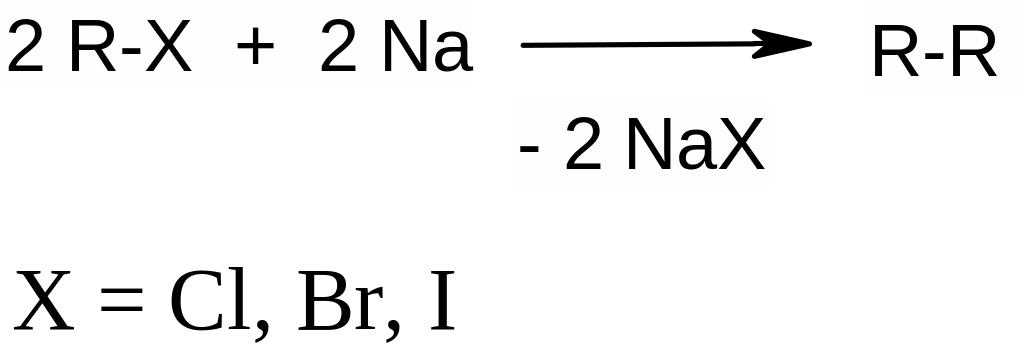
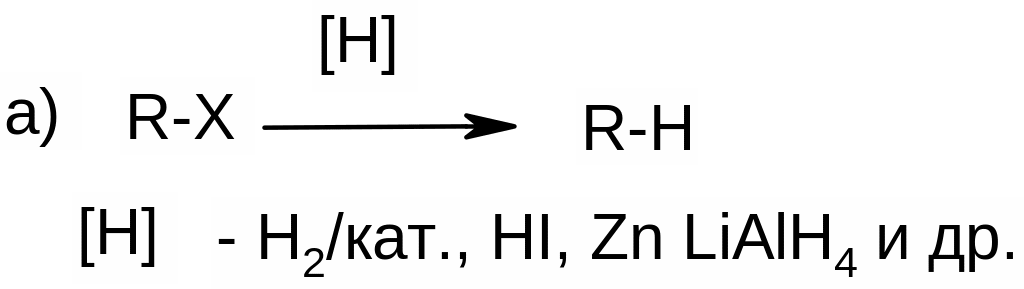
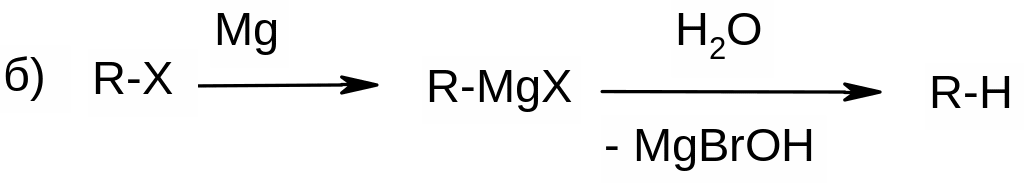
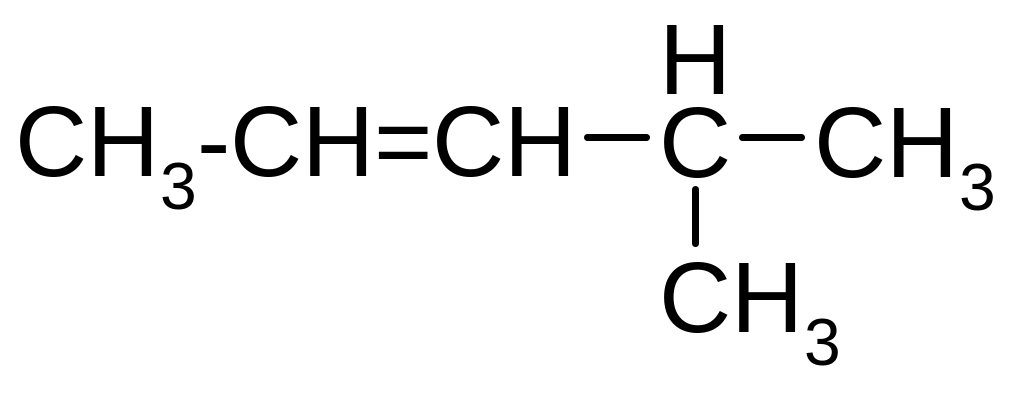 4-метил-2-пентен
4-метил-2-пентен