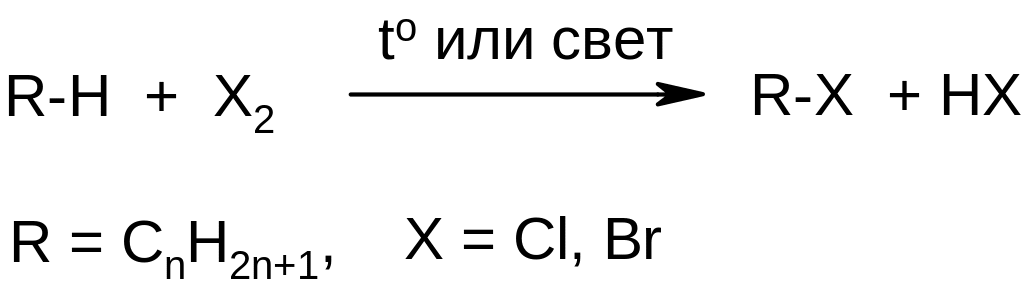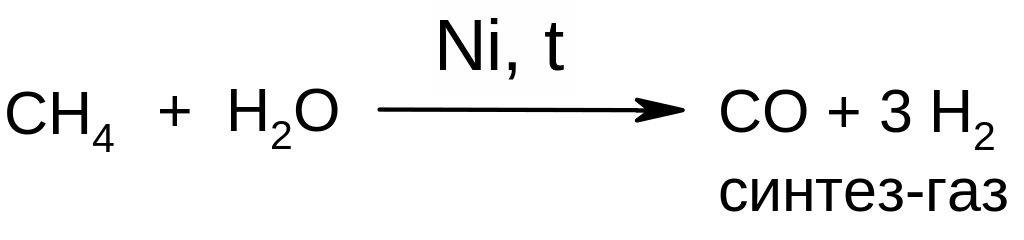- •Основные понятия органической химии
- •Классификация органических соединений
- •Гомология
- •Изомерия
- •Номенклатура алканов
- •Строение алканов
- •Физические свойства алканов
- •Химические свойства алканов
- •Промышленные методы получения алканов
- •Лабораторные методы получения алканов
- •Номенклатура алкенов
- •Строение алкенов
- •Физические свойства алкенов
- •Химические свойства алкенов
- •3) Реакции полимеризации:
- •5) Неполное окисление.
- •Промышленные методы получения алкенов
- •Диеновые углеводороды
- •Ароматические углеводороды (арены)
- •Физические свойства главных представителей ароматических углеводородов.
- •Нефть и ее переработка
- •Пример:
- •Гидроксильные производные углеводородов Определение: в молекуле гидроксилпроизводного один или несколько атомов водорода замещены на гидроксильную (он) группу.
- •Карбонильные соединения
- •Карбоновые кислоты Определение: в молекуле карбоновой кислоты содержится группа -соон (карбоксильная группа).
- •Монокарбоновые кислоты
- •Дисахариды
- •Полисахариды
- •Амины Определение: амины – это производные аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы (r).
- •Аминокислоты в состав молекул аминокислот входит две функциональные группы: карбоксильная –соон и аминогруппа –nh2.
- •Химические волокна
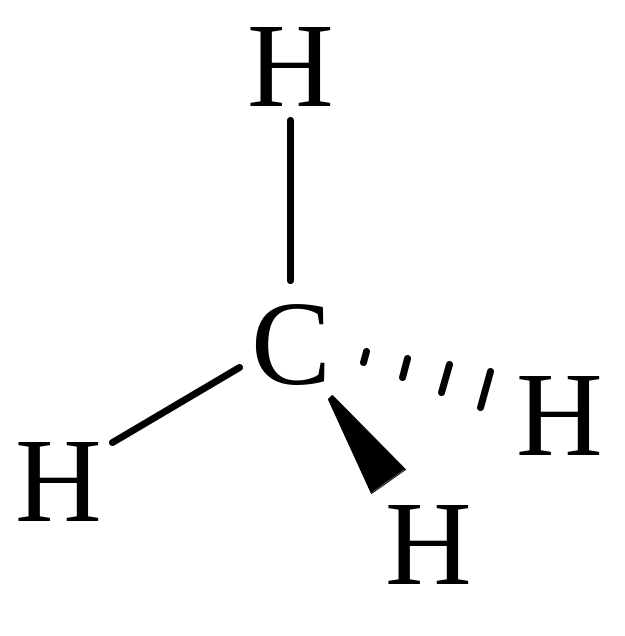
Строение алканов
Молекула метана представляет собой правильную треугольную пирамиду – тетраэдр, все четыре связи С-Н в которой равноценны (Есв = 415 кДж/моль, lсв = 0.109 нм), а валентные углы составляют 109°5’.
|
|
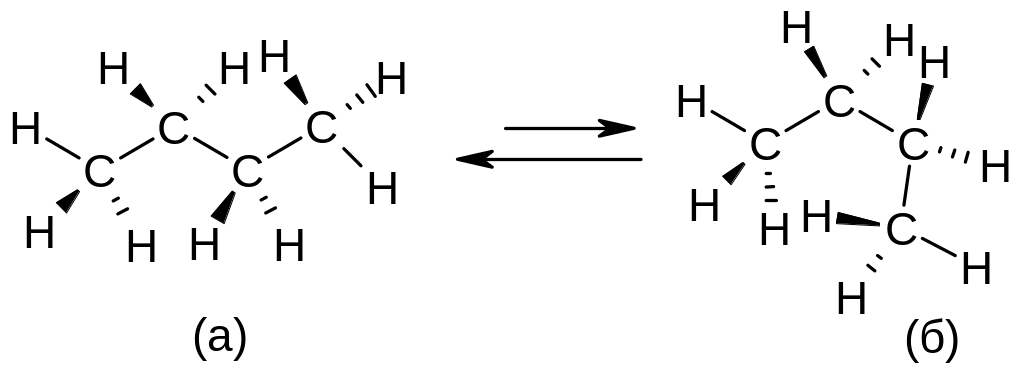
Различные пространственные формы (конформации) молекулы алканов могут принимать при вращении вокруг простых С-С связей1; число конформаций бесконечно велико. Две из них для молекулы бутана (а – более выгодная заторможенная и б - менее выгодная заслоненная) показаны на рисунке. |
|
С ростом длины цепи молекулы алкана различия в энергиях разных пространственных форм увеличиваются, и, следовательно, чем длиннее молекула, тем выгоднее для нее находиться в форме протяженной цепи (аналогичной (а) для молекулы бутана). Эта особенность играет очень важную роль в химии жизни.
Физические свойства алканов
Это бесцветные вещества, легче воды (относительная плотность < 1), с водой практически не смешиваются.
С увеличением количества атомов углерода в молекуле алкана температуры кипения и плавления повышаются (исключение – для Т. пл. первых трех членов ряда).
Агрегантое состояние н-алканов:
Количество С -атомов в алкане |
С1-С4 |
С5-С17 |
С18 и выше |
Агрегантое состояние |
газ |
жидкость |
Твердое вещество |
Физические свойства изомеров: для более разветвленного алкана характерна более низкая температура кипения:
алкан |
С4Н10 |
С5Н12 |
н-бутан изобутан |
н-пентан изопентан неопентан |
|
Т. пл., °С |
-138,4 -159,6 |
-129,7 -159,9 -16,6 |
Т. кип., °С |
-0,5 -11,7 |
36,1 27,8 9,5 |
Химические свойства алканов
1) Полное окисление (горение). Алканы воспламеняются на воздухе при температурах выше 300 оС: |
|
Применение: в энергетических целях, например, в двигателях внутреннего сгорания.
2) Неполное окисление. Происходит в присутствии катализаторов. При высоких температурах может сопровождаться разрывом С-С связей.
Применение: в промышленном органическом синтезе для получения кислородсодержащих соединений.
а) окисление метана:
|
|
б) окисление алканов до карбоновых кислот
|
|
Пример: окисление бутана в синтезе уксусной кислоты: |
|
3) Реакции замещения – радикальное хлорирование и бромирование. Протекают при действии хлора или брома на алкан на свету или при нагревании: |
|
Особенность – реакция хлорирования неизбирательна.
Соотношение образующихся изомерных продуктов реакции характеризует ее избирательность. Избирательной называют реакцию, в результате которой преимущественно образуется только один продукт из нескольких возможных.
Бром менее активен и реакция бромирования гораздо более избирательна.
Примеры:
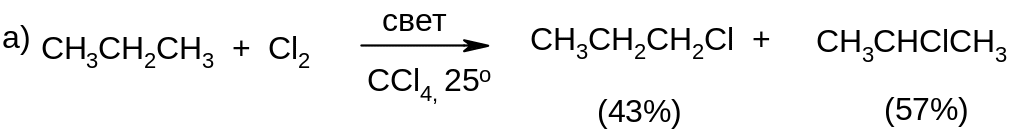

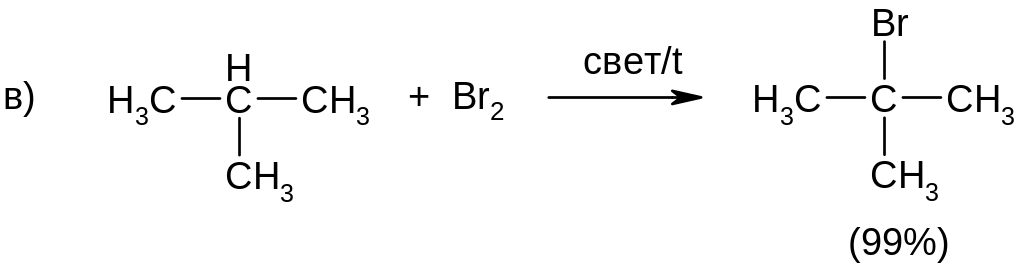
Применение: в химической промышленности для получения хлоруглеводородов.
Пример: при хлорировании метана получают четыре ценных продукта – хлорметан, дихлорметан, трихлорметан (хлороформ) и тетрахлорметан, из них три последние широко применяются как растворители:
![]()
4) Конверсия метана с водяным паром в смесь углерод(II)-оксида и водорода: |
|
Применение: образующийся так называемый синтез-газ используется в промышленных синтезах, например, для получения метанола.
5) Пиролиз. При сильном нагревании (до 1500°С) алканы разлагаются до углерода и водорода. Например: |
|
Применение: в производстве сажи.
6) Термический крекинг. Происходит при нагревании алканов до высоких температур.
а) крекинг метана. При быстром нагревании до температуры 1500оС происходит неполное разложение метана до ацетилена и водорода: |
|
Применение: реакция лежит в основе крупнотоннажного производства ацетилена. При электрокрекинге метан с большой скоростью пропускают через электрическую дугу между металлическими электродами при температуре 1500-1600С. Более экономичен термоокислительный крекинг – реакция протекает под действием теплоты, выделяющейся при сгорании метана в недостатке кислорода.
![]()
б) Крекинг алканов (гомологов метана). Протекает при температурах около 500оС. В этих условиях преобладающим процессом является разрушение связей С-С.
Пример – крекинг бутана:
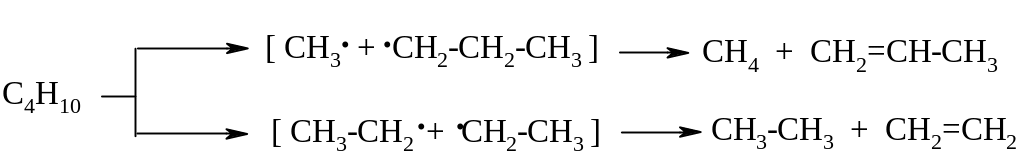
Применение: в нефтеперерабатывающей промышленности для получения низших алкенов.
7) Реакции изомеризации. Под действием кислот Льюиса (например, AlCl3, AlBr3) при повышенной температуре н-алканы частично превращаются в изоалканы. В итоге образуется равновесная смесь н-алкана и алканов изостроения:
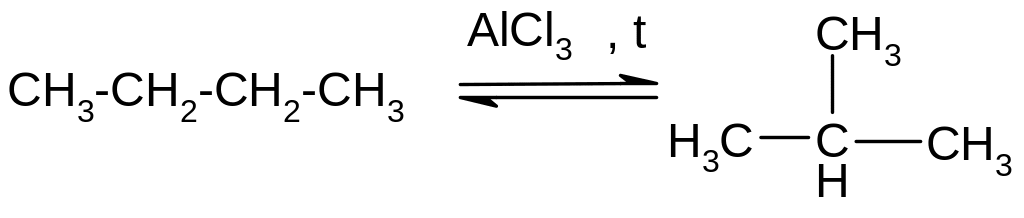
Применение: один из процессов каталитического крекинга, применяемого для производства высокооктанового топлива. Катализаторы процесса – алюмосиликаты.
Октановое число численно равно содержанию в объёмных процентах изооктана (2,2,4-триметилпентана), октановое число которого принято за 100, в его смеси с н-гептаном (его октановое число принято за 0), при котором эта смесь по стойкости к детонации эквивалентна испытуемому горючему.