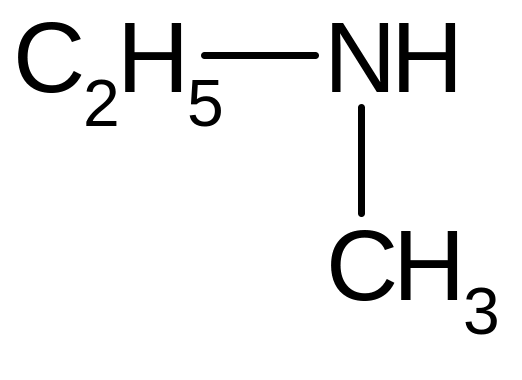- •Основные понятия органической химии
- •Классификация органических соединений
- •Гомология
- •Изомерия
- •Номенклатура алканов
- •Строение алканов
- •Физические свойства алканов
- •Химические свойства алканов
- •Промышленные методы получения алканов
- •Лабораторные методы получения алканов
- •Номенклатура алкенов
- •Строение алкенов
- •Физические свойства алкенов
- •Химические свойства алкенов
- •3) Реакции полимеризации:
- •5) Неполное окисление.
- •Промышленные методы получения алкенов
- •Диеновые углеводороды
- •Ароматические углеводороды (арены)
- •Физические свойства главных представителей ароматических углеводородов.
- •Нефть и ее переработка
- •Пример:
- •Гидроксильные производные углеводородов Определение: в молекуле гидроксилпроизводного один или несколько атомов водорода замещены на гидроксильную (он) группу.
- •Карбонильные соединения
- •Карбоновые кислоты Определение: в молекуле карбоновой кислоты содержится группа -соон (карбоксильная группа).
- •Монокарбоновые кислоты
- •Дисахариды
- •Полисахариды
- •Амины Определение: амины – это производные аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы (r).
- •Аминокислоты в состав молекул аминокислот входит две функциональные группы: карбоксильная –соон и аминогруппа –nh2.
- •Химические волокна
Амины Определение: амины – это производные аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы (r).
Классификация:
Первичные, вторичные, третичные амины определяют по числу углеводородных радикалов (R, R’, R’’ –могут быть одинаковыми или разными), связанных с атомом азота:

алифатические амины. R – алкильная группа (насыщенные, или алкиламины), R - алкенильная группа (ненасыщенные амины).
Ароматические амины (ариламины). R – арильная группа.
Названия первичных аминов строятся из названия радикала R, к которому добавляют окончание –амин (обозначает присутствие аминогруппы NH2).
Названия вторичных и третичных аминов строятся из названий радикалов R, R’ и R’’, которые перечисляют в алфавитном порядке, + окончание –амин.
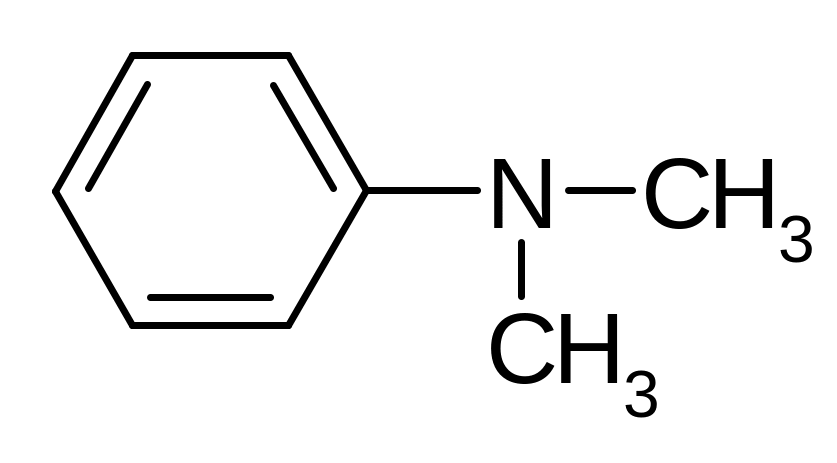
Анилин - тривиальное название простейшего ариламина (фениламина), принятое IUPAC. В названиях вторичных и третичных ариламинов используют буквенный локант N- (который указывает на то, что заместитель находится не в ядре, а у атома азота).
Примеры:
Формула амина |
классификация |
название |
Формула амина |
классификация |
название |
|
Насыщенный первичный |
Метиламин |
|
насыщенный вторичный |
Метилэтил-амин |
|
Насыщенный первичный |
Трет.-бутиламин |
|
Ариламин первичный |
анилин |
|
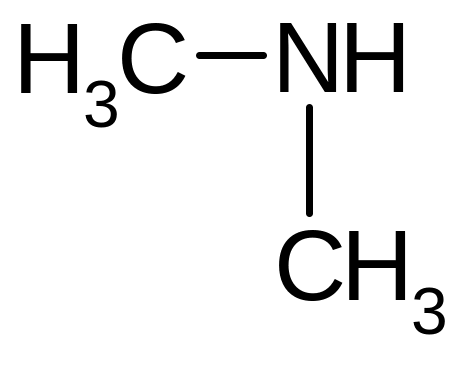
Насыщенный вторичный |
диметиламин |
|
алкилариламин вторичный |
N-метиланилин |
|
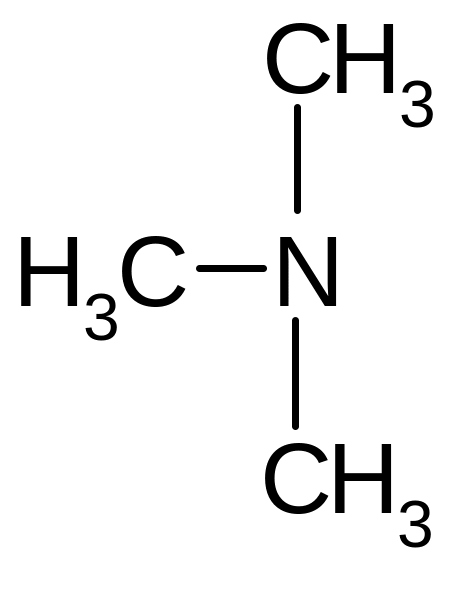
насыщенный третичный |
Триметил-амин |
|
алкилариламин третичный |
N, N –ди-метиланилин |
Строение аминов. А) Связи N-H и C-N в молекуле амина достаточно прочны, а их полярность невелика. Поэтому амины не проявляют заметных кислотных свойств, и для них нехарактерны реакции замещения аминогруппы.
Б) На атома азота имеется неподеленная электронная пара, и амины, аналогично аммиаку, способны отдавать ее на образование новой связи (проявляют основные и нуклеофильные свойства).
Физические свойства аминов.
А) Температуры кипения аминов выше, чем у углеводородов с близкой молекулярной массой, но часто ниже, чем у соответствующих спиртов (причина – слабые водородные связи);
Б) за счет водородных связей температуры кипения первичных аминов выше, чем изомерных им вторичных и третичных.
Соединение |
(СН3)3N |
н-С3Н7NH2 |
(C2H5)2NH |
C4H10 |
Т. кип., С |
3,5 |
98,7 |
55,5 |
-0,5 |
В) низшие амины (метиламин, диметиамин, триметиламин, этиламин) – газы.
Г) Летучие амины имеют характерный аммиачный запах.
Д) Амины хорошо растворимы в воде, с ростом молекулярной массы растворимость падает.
Химические свойства аминов.
Основность аминов. За счет неподеленной пары электронов амины обладают сродством к протону.
А) Взаимодействие с кислотами:
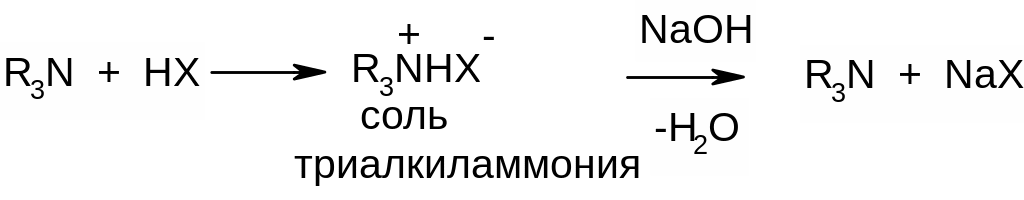
Образующиеся соли триалкиламмония под действием оснований снова превращаются в свободные амины.
Применение реакции: некоторые амины (например, триэтиламин, пиридин31) широко применяют как органические основания, т. е. добавляют в реакционные смеси для связывания выделяющейся в ходе реакции кислоты.
Б) Взаимодействие с водой. Водные растворы аминов имеют щелочную реакцию за счет образования гидроксид-ионов:
![]()
Основность аминов. Основность алкиламинов выше, чем аммиака. Анилин, наоборот, является гораздо более слабым основанием: он не взаимодействует с водой, а только с сильными кислотами. Причина – сопряжение между неподеленной электронной парой NН2-группы и -электронами бензольного кольца, результатом чего является обеднение электронной плотностью атома азота и обогащение электронной плотностью орто- и пара-положений бензольного кольца:

Полное окисление аминов (горение):
![]()
Применение реакции: в количественном элементном анализе (определение содержания азота).
Реакции электрофильного замещения в анилине. Вследствие влияния аминогруппы происходит обогащение электронной плотностью орто- и пара-положений бензольного кольца, поэтому анилин вступает в реакции электрофильного замещения гораздо легче, чем бензол. Пример: бромирование бромной водой:
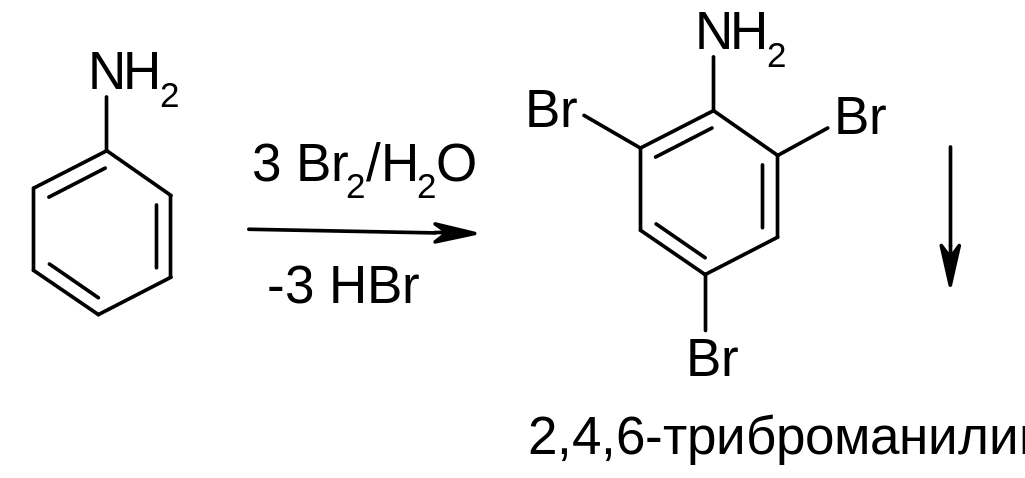
Применение реакции: в качественном функциональном анализе. Обесцвечивание бромной воды и образование белого осадка свидетельствует о наличии анилина (следует, однако помнить, что фенол также дает аналогичную реакцию, поэтому данный тест, также как и другие качественные реакции, следует применять в комплексе с другими реакциями и прочими методами установления структуры вещества).
Промышленные методы получения аминов.
1) Алкилирование аммиака спиртами. В присутствии кислотных катализаторов (серная кислота или оксиды, например Al2O3) осуществляется замещение ОН-группы спирта на аминогруппу. Так, метиламины получают из метанола и аммиака под давлением на оксиде алюминия. Обычно образуется смесь всех трех аминов. В избытке спирта она обогащена третичным амином, а в избытке аммиака – первичным.
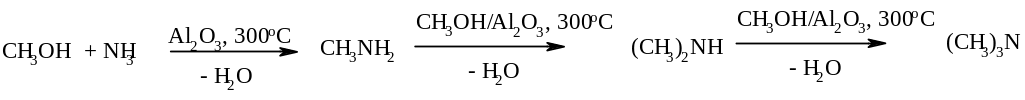 Аналогично,
в промышленности метилируют анилин.
Аналогично,
в промышленности метилируют анилин.
Получение анилина – каталитическим восстановлением нитробензола водородом:
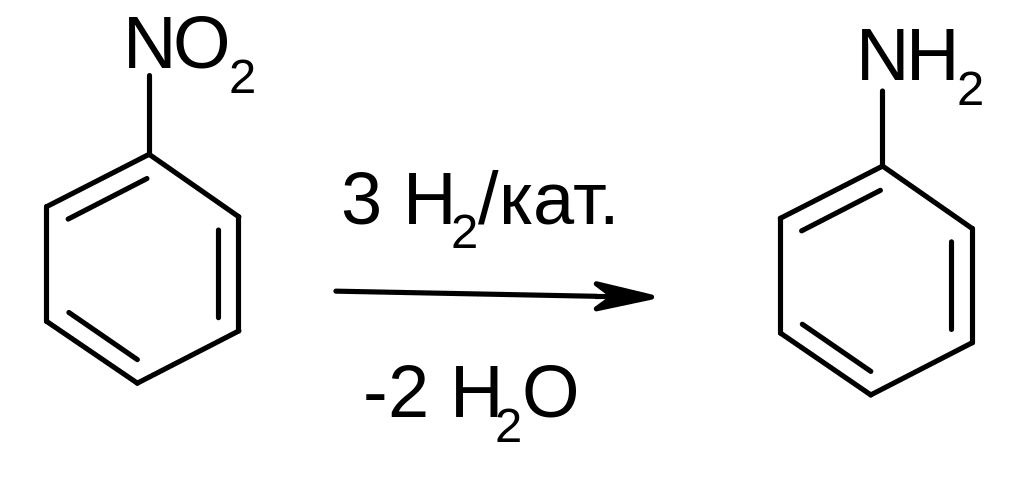
Лабораторные методы получения аминов
Алкилирование аммиака и аминов. В лаборатории в качестве алкилирующих средств используют галогеналканы. Алкилированием аммиака получают первичные амины. Из первичных аминов получаются вторичные, из вторичных - третичные. Пример:
![]()
восстановление нитросоединений. В лаборатории в качестве восстановителей применяют металлы (например, железо) в соляной кислоте, сероводород или сульфиды, литийалюминий гидрид. При проведении реакции в кислой среде образуется гидрохлорид анилина, который выделяют в свободном виде действием щелочи:
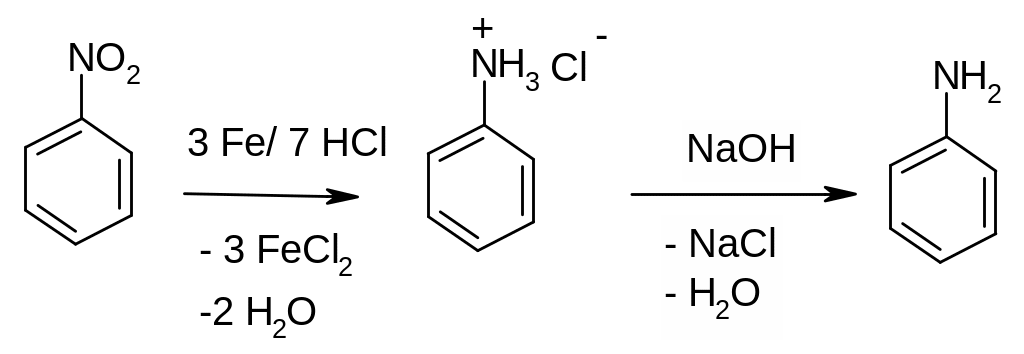
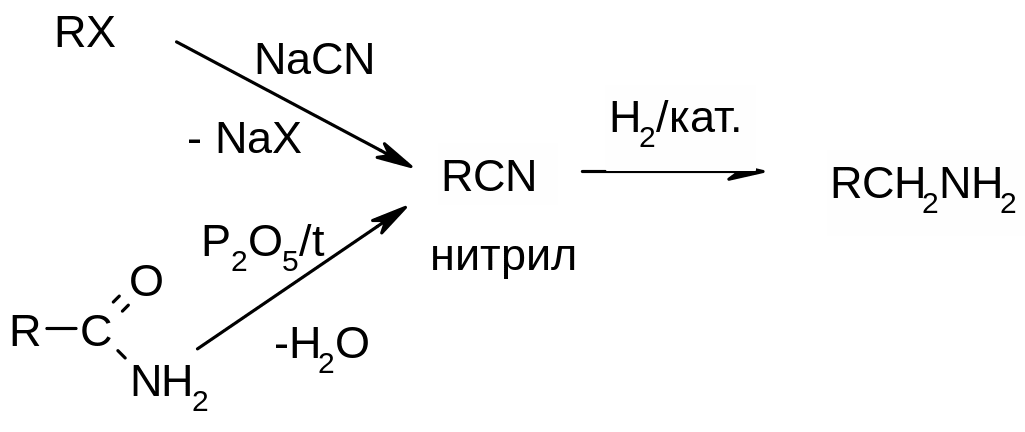
восстановление нитрилов (органических соединений с цианогруппой). Нитрилы получают из доступных галогенуглеводородов или амидов.