- •Основные понятия органической химии
- •Классификация органических соединений
- •Гомология
- •Изомерия
- •Номенклатура алканов
- •Строение алканов
- •Физические свойства алканов
- •Химические свойства алканов
- •Промышленные методы получения алканов
- •Лабораторные методы получения алканов
- •Номенклатура алкенов
- •Строение алкенов
- •Физические свойства алкенов
- •Химические свойства алкенов
- •3) Реакции полимеризации:
- •5) Неполное окисление.
- •Промышленные методы получения алкенов
- •Диеновые углеводороды
- •Ароматические углеводороды (арены)
- •Физические свойства главных представителей ароматических углеводородов.
- •Нефть и ее переработка
- •Пример:
- •Гидроксильные производные углеводородов Определение: в молекуле гидроксилпроизводного один или несколько атомов водорода замещены на гидроксильную (он) группу.
- •Карбонильные соединения
- •Карбоновые кислоты Определение: в молекуле карбоновой кислоты содержится группа -соон (карбоксильная группа).
- •Монокарбоновые кислоты
- •Дисахариды
- •Полисахариды
- •Амины Определение: амины – это производные аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы (r).
- •Аминокислоты в состав молекул аминокислот входит две функциональные группы: карбоксильная –соон и аминогруппа –nh2.
- •Химические волокна
Карбонильные соединения
Определение: в молекуле карбонильного соединения содержится группа С=О (карбонильная группа).
Классификация и номенклатура:
1) альдегиды – общая формула: |
|
Названия альдегидов по заместительной номенклатуре происходят от названий родоначального углеводорода, к которым добавляют суффикс –аль.
Нумерация. Первый номер получает атом углерода карбонильной группы (связанный с атомом кислорода).
2) кетоны – общая формула: |
|
Названия кетонов по заместительной номенклатуре происходят от названий родоначального углеводорода, к которым добавляют суффикс –он.
Нумерация. Меньший номер получает атом углерода карбонильной группы (связанный с атомом кислорода).
Важнейшие представители:
формула |
Систематическое и тривиальное название |
формула |
Систематическое и тривиальное название |
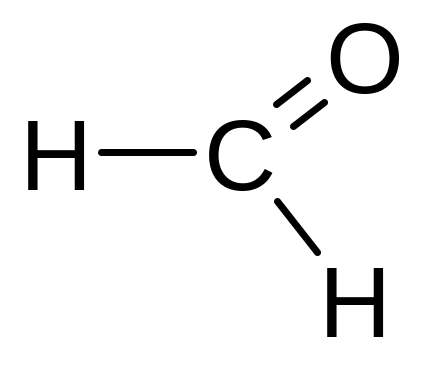
|
Метаналь; Муравьиный альдегид; формальдегид |
|
Пентаналь; Валериановый альдегид |
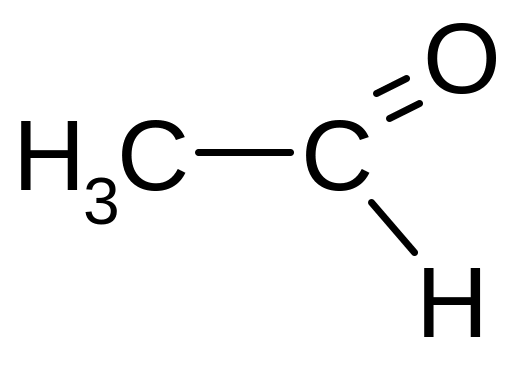
|
Этаналь; Уксусный альдегид |
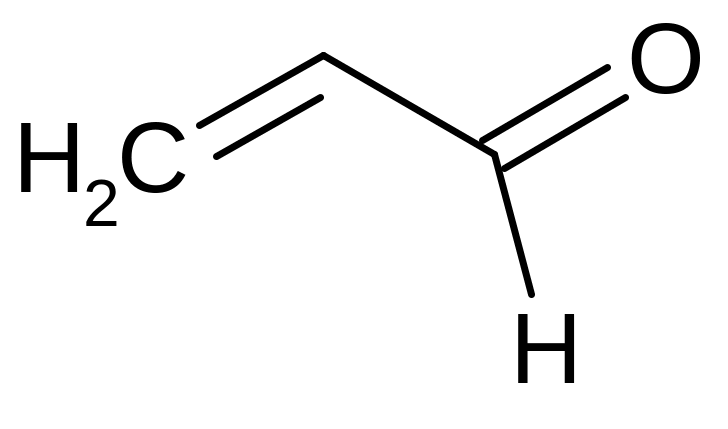
|
Пропен-2-аль; Акролеин |
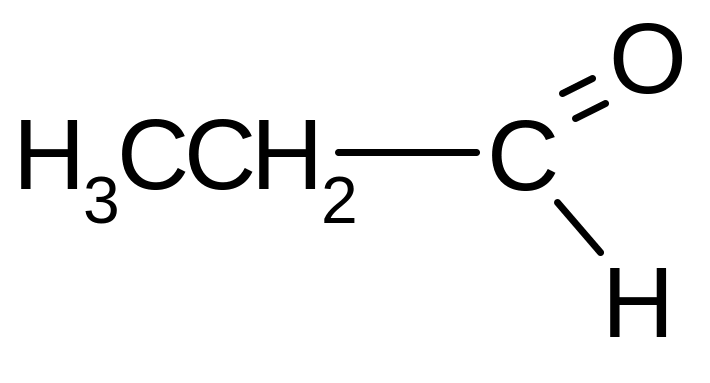
|
Пропаналь; Пропионовый альдегид |
|
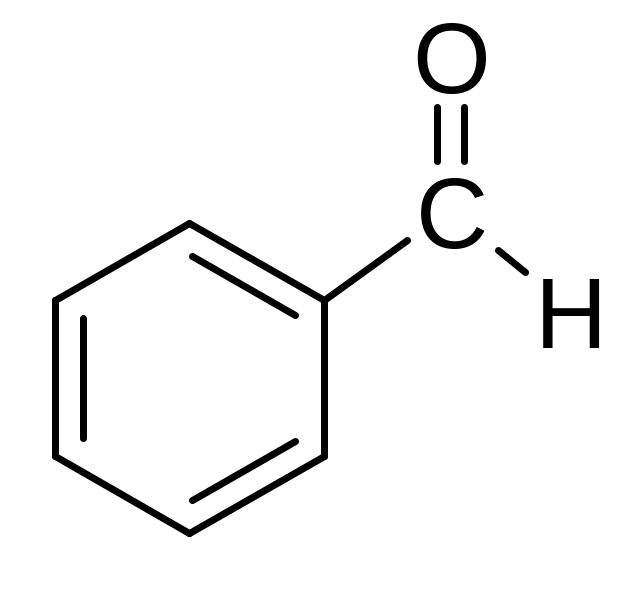
Бензальдегид; Бензойный альдегид |
|
Бутаналь; Масляный альдегид |
|
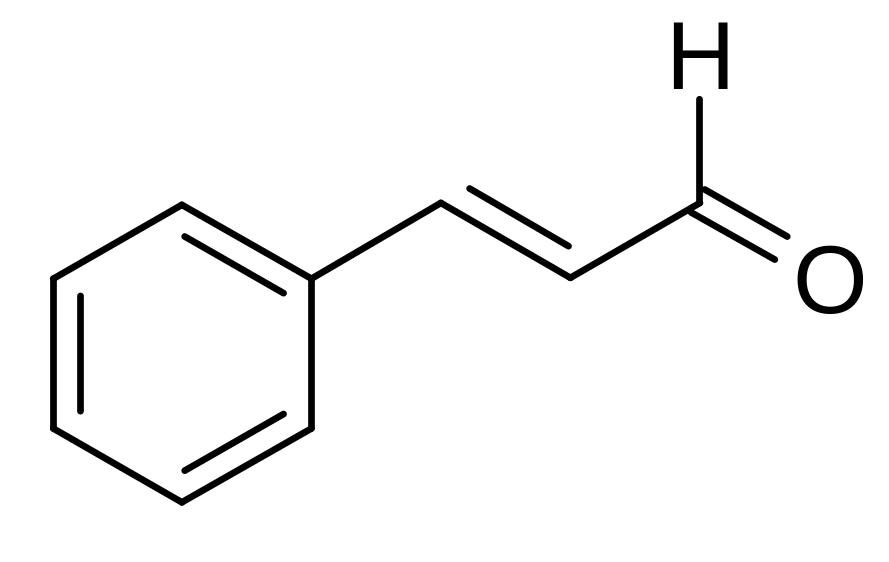
3-фенилпропен-2-аль; Коричный альдегид |
|
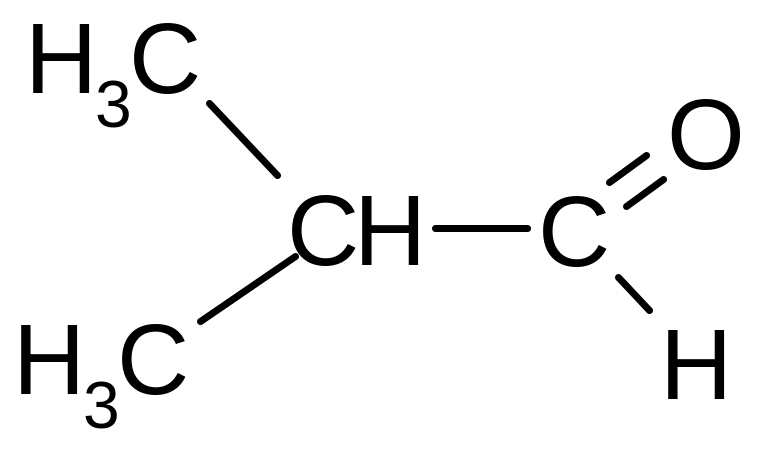
2-метилпропаналь; Изомасляный альдегид |
|
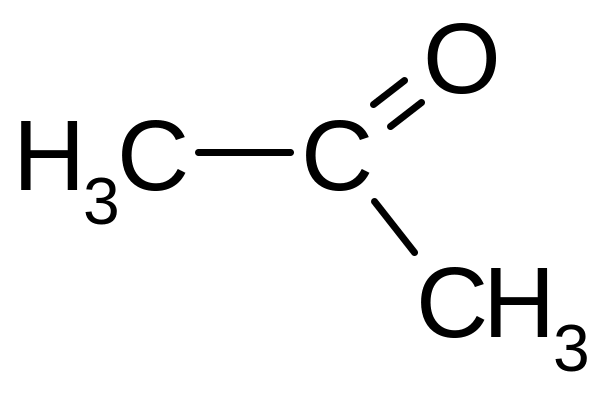
Пропанон; ацетон |
Строение карбонильной группы. А) Три -связи, образуемые атомом углерода карбонильной группы, лежат в одной плоскости под углом 120. Плоскость -связи перпендикулярна плоскости -связей20.
Б) связь С=О полярна. Вследствие сильной подвижности электронов -связи выше на атоме углерода карбонильной группы возникает заметный положительный заряд:

Полярность связи С=О отражается в реакционной способности карбонильных соединений, которые, аналогично алкенам, вступают в реакции присоединения, но реагент, атакующий атом углерода карбонильной группы, является донором электронов (нуклеофил).
Физические свойства карбонильных соединений. Наличие полярной группы обусловливает хорошую растворимость в воде низших представителей (формальдегид, уксусный альдегиды, ацетон). 40% Водный раствор формальдегида известен как формалин (применяется как дезинфицирующее средство).
Отсутствие водородных связей между молекулами карбонильных соединений обусловливает их более низкие по сравнению со спиртами температуры кипения.
Агрегантое состояние насыщенных альдегидов (алканалей).
Количество С-атомов в альдегиде |
С1 |
С2-С11 |
С12 и выше |
Агрегантое состояние |
газ |
жидкость |
Твердое вещество |
Химические свойства карбонильных соединений.
Реакции присоединения.
А) Присоединение водорода (гидрирование). Протекает в присутствие металлических катализаторов (Pd, Ni, Pt, Rh и др.):
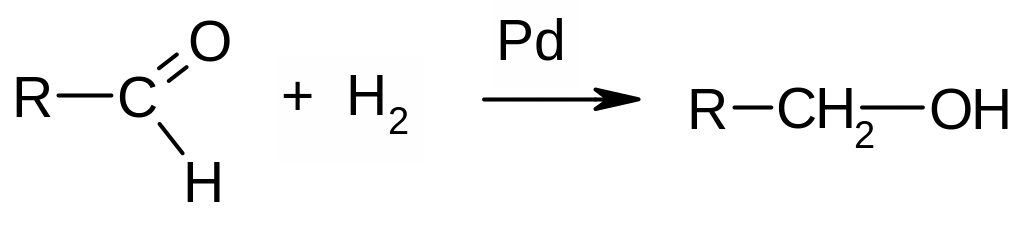
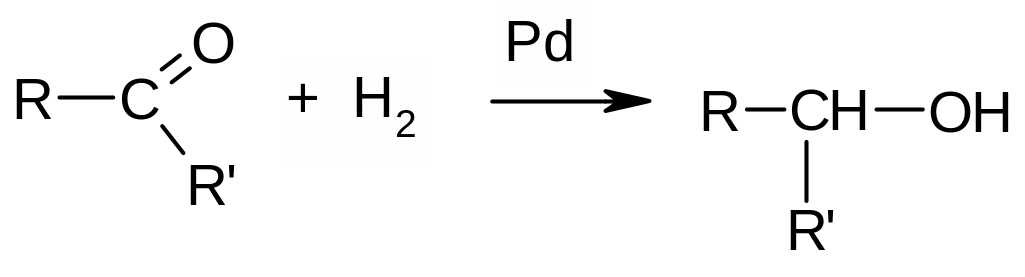
Применение реакции: промышленные и лабораторные методы получения первичных и вторичных спиртов. Пример:
б) присоединение комплексных гидридов (литийалюминийгидрида, натрийборгидрида):
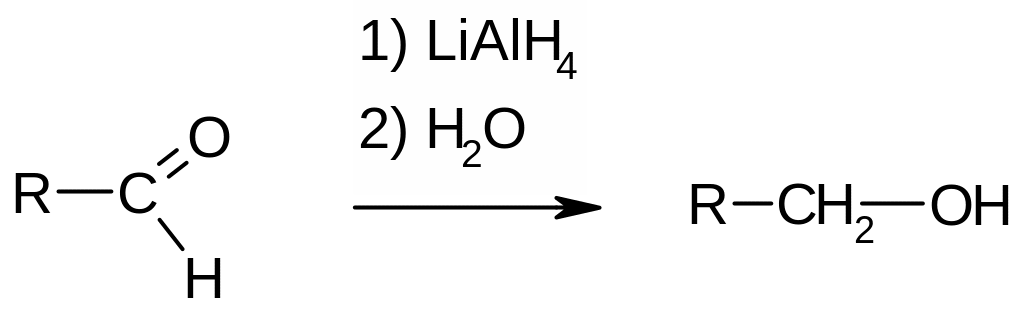
Применение реакции: лабораторные методы получения первичных и вторичных спиртов.
в) Присоединение воды и спиртов. Характерно для альдегидов и кетонов, но альдегиды более активны. Реакция обратима. Продукты присоединения (гидраты и полуацетали), как правило, неустойчивы и в чистом виде не выделяются:
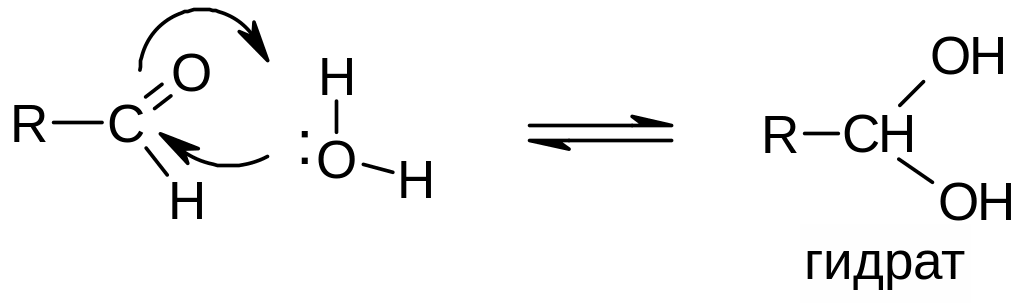
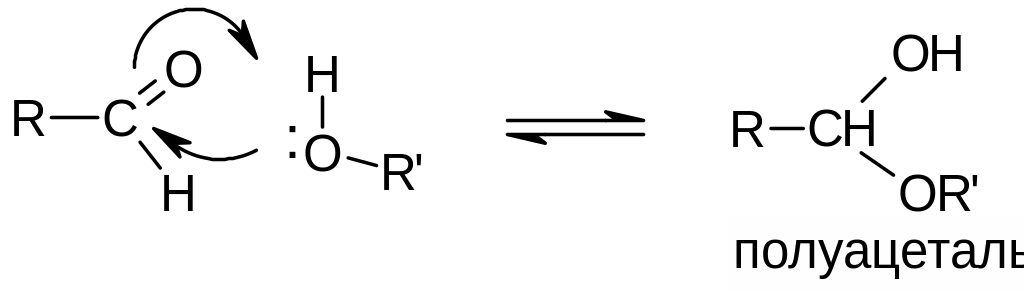
Применение (значение) реакции: в химии углеводов – циклические формы углеводов являются примером устойчивых циклических полуацеталей.
В присутствие кислотных катализаторов образующийся полуацеталь вступает дальше в реакцию межмолекулярной дегидратации с еще одной молекулой спирта, давая в конечном итоге продукт взаимодействия 1 моль карбонильного соединения с 2 моль спирта – ацеталь:
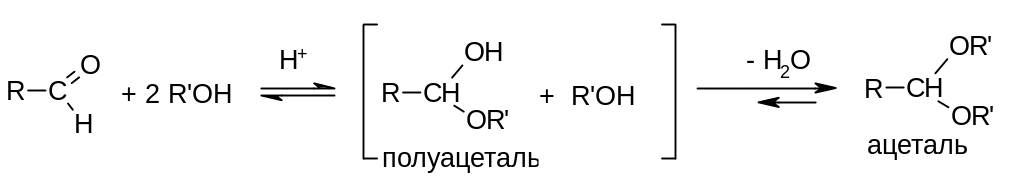
Применение реакции: ацетали используются в качестве растворителей (например, метилаль СН2(ОСН3)2), в качестве душистых веществ в парфюмерной промышленности, а также как промежуточные продукты в органическом синтезе.
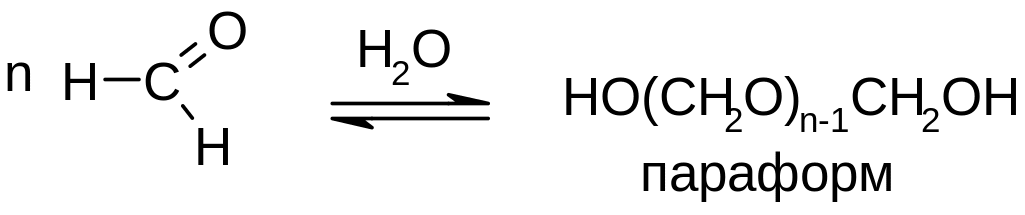
Реакции полимеризации. Характерны для активных альдегидов.
А) формальдегид легко полимеризуется. Известны полимеры линейного строения, а также циклические тримеры и тетрамеры:
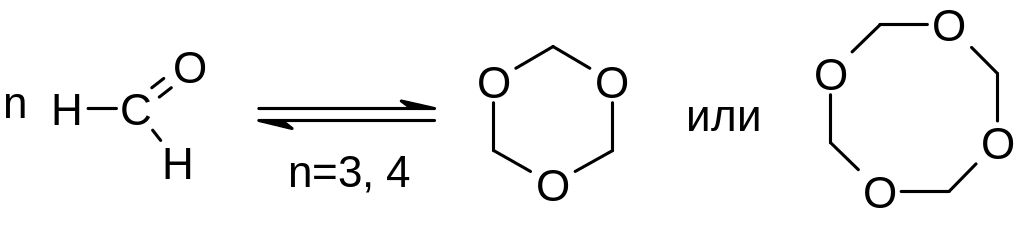
б) Уксусный альдегид легко дает циклический тример (реакция катализируется кислотами):
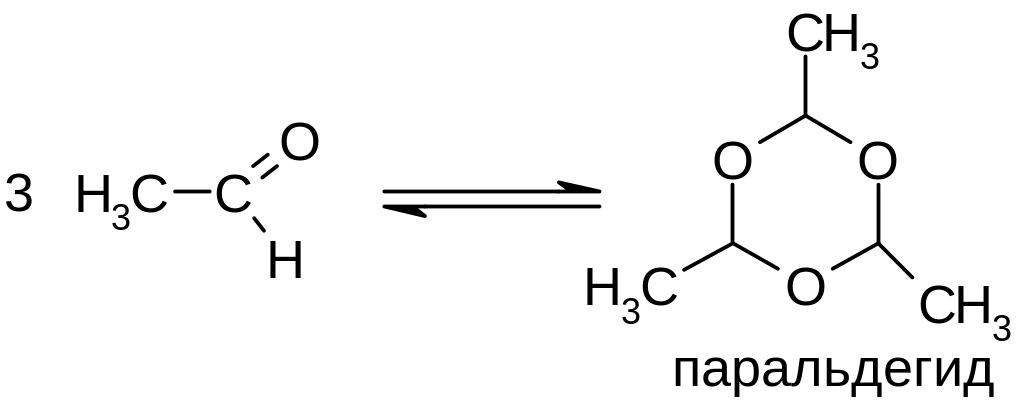
реакции галогенирования
а) Замещение атома кислорода карбонильной группы:

Применение реакции: получение дихлоралканов и далее из них – алкинов:
Б) Замещение атома водорода в -положении к карбонильной группе. Реакция катализируется кислотами или основаниями. В зависимости от условий проведения реакции замещается один или больше -атомов водорода:
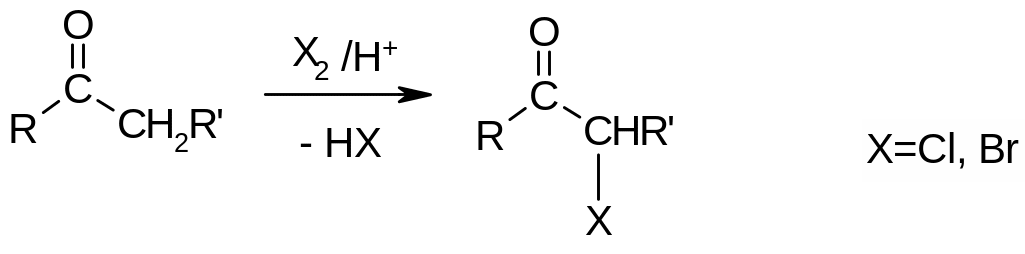
Применение реакции: получение трихлоруксусного альдегида (хлораля). Существует в виде устойчивого гидрата (хлоральгидрат), который применяется в медицине (успокаивающее, снотворное, анестезирующее средство), а также в промышленности для получения хлороформа:
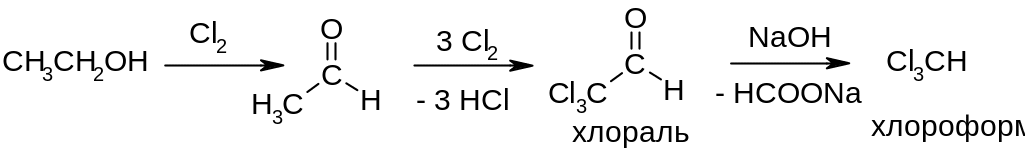
Альдольные реакции карбонильных соединении. Обычно осуществляют в присутствие основания (катализатор процесса). В ходе реакции происходит димеризация карбонильного соединения, причем образуется связь между атомом углерода карбонильной группы одной молекулы исходного соединения и -углеродным атомом другой молекулы - образуется -гидроксикарбонильное соединение (альдоль):
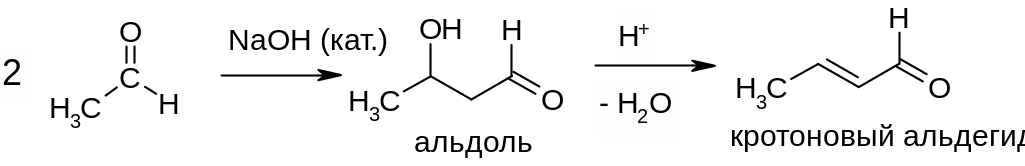
Применение реакции: дегидратация альдолей – промышленный и лабораторный способ получения ненасыщенных карбонильных соединений (например, из уксусного альдегида получают кротоновый альдегид).
Реакции с фенолом (см. химические свойства фенолов).
Фенолоформальдегидные смолы образуются в результате поликонденсации21 фенола с формальдегидом:

При нагревании смолы с избытком формальдегида происходит дальнейшая конденсация с образованием СН2-мостиков между цепями (образуется жесткая сетчатая структура полимера):
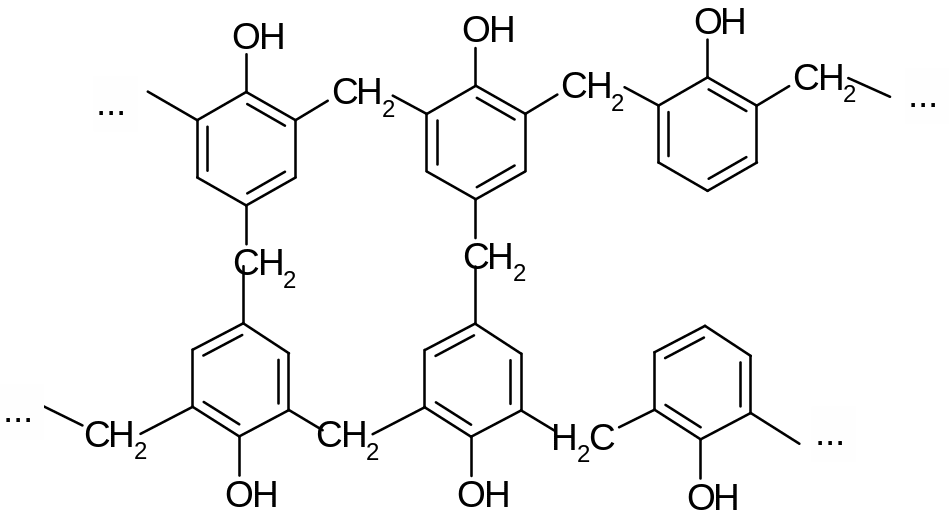
В промышленности это нагревание (с наполнителем) производят в специальных пресс-формах, из которых вынимают уже готовые изделия. Процесс применяют при изготовлении электрических розеток, выключателей, некоторых деталей машин.
Древесно-слоистые пластики получают пропиткой шпона древесины феноло-формальдегидной смолой и спрессовыванием их в листы или плиты.
Реакции окисления карбонильных соединений.
А) неполное окисление (до карбоновых кислот). Альдегиды легко окисляются до карбоновых кислот, причем в качестве окислителей можно использовать не только кислород воздуха или хромовую кислоту, но и такие мягкие окислители, как ионы Cu2+ или Ag+. Так, при слабом нагревании с аммиачным раствором оксида серебра происходит окислительно-восстановительная реакция, сопровождающаяся выделением на стенках пробирки металлического серебра:
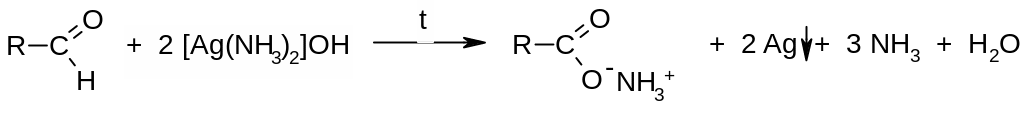
Аналогичная окислительно-восстановительная реакция, но при более сильном нагревании, протекает и с медь(II)-гидроксидом, в результате исчезает голубой цвет медь(II)-гидроксида и выделяется красный осадок медь(I)-оксида:
![]()
Применение реакций: качественные реакции на альдегиды, поскольку кетоны в этих условиях не окисляются22.
Б) Полное окисление карбонильных соединений (горение). Карбонильные соединения горят за счет наличия в их молекулах углеводородных остатков:
![]()
Промышленные методы получения карбонильных соединений.
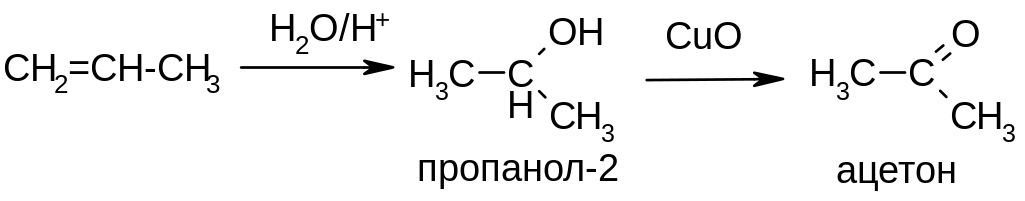
Из спиртов – каталитическим дегидрированием (окислением кислородом воздуха) (см. реакции окисления спиртов). Пример: получение ацетона из пропена:
Из алкенов – каталитическим окислением (см. реакции окисления спиртов) или карбонилированием:
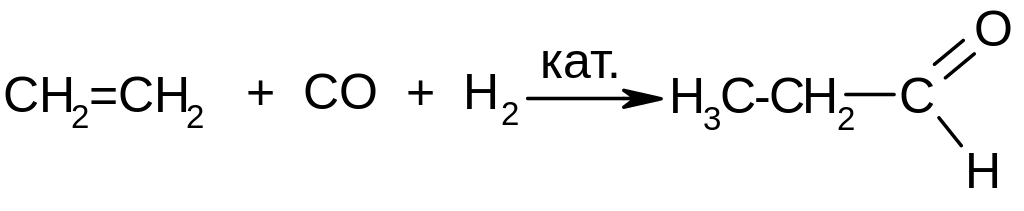
Получение формальдегида: а) из метанола окислением кислородом воздуха над медным, серебряным или железо-молибденовом катализатором (основной метод); б) каталитическим окислением метана.
Получение уксусного альдегида:
а) основная масса уксусного альдегида производится из этилена. Основной метод – окисление этилена в присутствии палладиевого катализатора (процесс Уоккера); второй метод - гидратация этилена и последующее окисление этанола23 над медным или серебряным катализатором:
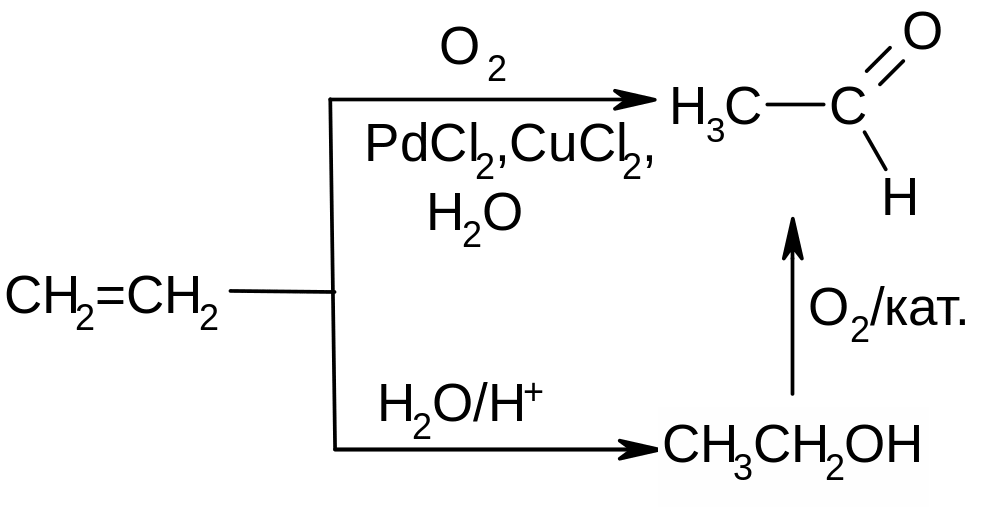
б) Более старые способы - из ацетилена прямой гидратацией на ртутном катализаторе (по Кучерову) или менее токсичном кадмиевом. Альтернативный способ - через бутилвиниловый эфир:
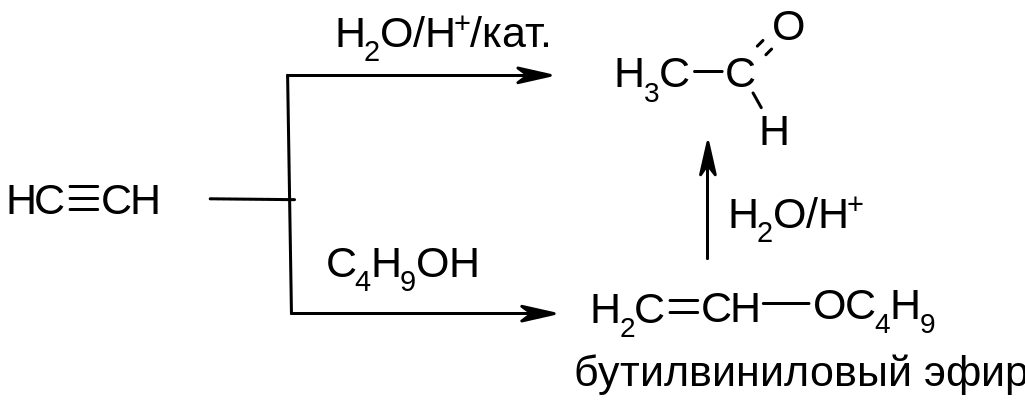
Лабораторные методы получения карбонильных соединений.
1) Окисление спиртов (см. реакции окисления спиртов).
Гидролиз дигалогеналканов:
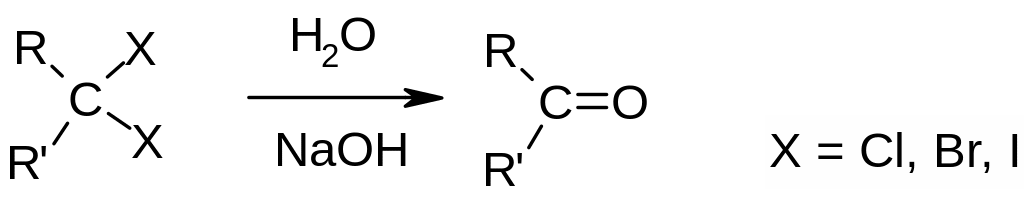
Гидратация алкинов (см. реакции алкинов).