
- •Молекулярная физика
- •Основное уравнение молекулярно-кинетической теории идеального газа
- •Наиболее вероятная скорость молекул — это скорость, вблизи которой на единичный интервал скоростей приходится наибольшее число молекул
- •Барометрическая формула — определяет зависимость давления или плотности газа от высоты в поле тяжести
- •Первый постулат Бора: постулат стационарных состояний
- •Второй постулат Бора: правило частот
- •Постоянная Ридберга — постоянная для изучения спектров излучения атомов
- •Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором всех четырех квантовых чисел n, l, m, s.
- •Энергия связи
- •Закон радиоактивного распада -описывает зависимость радиоактивного распада от времени и количестве радиоактивных атомов в данном образце
Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором всех четырех квантовых чисел n, l, m, s.
_18. Строение атомного ядра, размеры и масса ядер. Заряд ядра и массовое число, изотопы. Энергия связи и дефект массы ядра.
В 1932г. после открытия протона и нейтрона учеными Д.Д. Иваненко (СССР) и В. Гейзенберг (Германия) была выдвинута протонно-нейтронная модель ядра атома. Согласно этой модели: - ядра всех химических элементов состоят из нуклонов: протонов и нейтронов - заряд ядра обусловлен только протонами - число протонов в ядре равно порядковому номеру элемента - число нейтронов равно разности между массовым числом и числом протонов (N=A-Z) Условное обозначение ядра атома химического элемента:
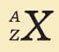 X
– символ химического элемента
А
– массовое число, которое показывает
:
- массу ядра в целых атомных
единицах массы (а.е.м.)
(1а.е.м. =
1/12 массы атома углерода)
- число
нуклонов в ядре
- (A = N + Z) , где N –
число нейтронов в ядре атома
Z –
зарядовое число, которое показывает:
-
заряд ядра в элементарных электрических
зарядах (э.э.з.)
( 1э.э.з. = заряду электрона
= 1,6 х 10 -19 Кл)
- число протонов
- число
электронов в атоме
- порядковый номер
в таблице Менделеева
Масса ядра
всегда меньше суммы масс покоя свободных
протонов и нейтронов, его составляющих.
Это объясняется тем, что протоны и
нейтроны в ядре очень сильно притягиваются
друг к другу. Чтобы разъединить их
требуется затратить большую работу.
Поэтому полная энергия покоя ядра не
равна энергии покоя составляющих его
частиц. Она меньше на величину работы
по преодолению ядерных сил
притяжения.
Разность между массой
ядра и суммой масс протонов и нейтронов
называется дефектом масс.
X
– символ химического элемента
А
– массовое число, которое показывает
:
- массу ядра в целых атомных
единицах массы (а.е.м.)
(1а.е.м. =
1/12 массы атома углерода)
- число
нуклонов в ядре
- (A = N + Z) , где N –
число нейтронов в ядре атома
Z –
зарядовое число, которое показывает:
-
заряд ядра в элементарных электрических
зарядах (э.э.з.)
( 1э.э.з. = заряду электрона
= 1,6 х 10 -19 Кл)
- число протонов
- число
электронов в атоме
- порядковый номер
в таблице Менделеева
Масса ядра
всегда меньше суммы масс покоя свободных
протонов и нейтронов, его составляющих.
Это объясняется тем, что протоны и
нейтроны в ядре очень сильно притягиваются
друг к другу. Чтобы разъединить их
требуется затратить большую работу.
Поэтому полная энергия покоя ядра не
равна энергии покоя составляющих его
частиц. Она меньше на величину работы
по преодолению ядерных сил
притяжения.
Разность между массой
ядра и суммой масс протонов и нейтронов
называется дефектом масс.
Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома.
Полное
количество нуклонов в ядре называется
его массовым
числом
![]() (
(![]() )
и приблизительно равно средней массе
атома, указанной в таблице Менделеева.
)
и приблизительно равно средней массе
атома, указанной в таблице Менделеева.
Зарядовым
числом
![]() полностью
определяется химический
элемент. Парой чисел
и
(массовое
число) полностью определяется
нуклид.
Можно рассмотреть некоторые
ядерно-физические характеристики
нуклидов с заданными зарядовыми и
массовыми числами.
полностью
определяется химический
элемент. Парой чисел
и
(массовое
число) полностью определяется
нуклид.
Можно рассмотреть некоторые
ядерно-физические характеристики
нуклидов с заданными зарядовыми и
массовыми числами.
Заряд
Число протонов в ядре определяет непосредственно его электрический заряд, у изотопов одинаковое количество протонов, но разное количество нейтронов. Ядерные свойства изотопов элемента в отличие от химических, могут различаться чрезвычайно резко.
Впервые заряды атомных ядер определил Генри Мозли в 1913 году. Свои экспериментальные наблюдения учёный интерпретировал зависимостью длины волны рентгеновского излучения от некоторой константы , изменяющейся на единицу от элемента к элементу и равной единице для водорода:
![]() ,
где
,
где
![]() и
и
![]() —
постоянные.
—
постоянные.
Из чего Мозли сделал вывод, что найденная в его опытах константа атома, определяющая длину волны характеристического рентгеновского излучения и совпадающая с порядковым номером элемента, может быть только зарядом атомного ядра, что стало известно под названием закон Мозли.
Масса
Из-за
разницы в числе нейтронов
![]() изотопы
элемента имеют разную массу
изотопы
элемента имеют разную массу
![]() ,
которая является важной характеристикой
ядра. В ядерной физике массу ядер принято
измерять в атомных
единицах массы (а. е. м.),
за одну а. е. м. принимают 1/12 часть массы
нуклида 12C[сн
2]. Следует отметить,
что стандартная масса, которая обычно
приводится для нуклида — это масса
нейтрального атома.
Для определения массы ядра нужно из
массы атома вычесть сумму масс всех
электронов
(более точное значение получится, если
учесть еще и энергию связи электронов
с ядром).
,
которая является важной характеристикой
ядра. В ядерной физике массу ядер принято
измерять в атомных
единицах массы (а. е. м.),
за одну а. е. м. принимают 1/12 часть массы
нуклида 12C[сн
2]. Следует отметить,
что стандартная масса, которая обычно
приводится для нуклида — это масса
нейтрального атома.
Для определения массы ядра нужно из
массы атома вычесть сумму масс всех
электронов
(более точное значение получится, если
учесть еще и энергию связи электронов
с ядром).
Кроме
того, в ядерной физике часто используется
энергетический
эквивалент массы. Согласно
соотношению Эйнштейна,
каждому значению массы
![]() соответствует
полная энергия:
соответствует
полная энергия:
![]() ,
где
,
где
![]() —
скорость
света в вакууме.
—
скорость
света в вакууме.
Соотношение между а. е. м. и её энергетическим эквивалентом в джоулях:
![]() ,
,
а так как 1 электронвольт = 1,602176·10−19 Дж, то энергетический эквивалент а. е. м. в МэВ равен:
![]() .
.
Ма́ссовое число́ атомного ядра — суммарное количество протонов и нейтронов (называемых общим термином «нуклоны») в ядре. Обычно обозначается буквой A. Массовое число близко к атомной массе изотопа, выраженной в атомных единицах массы, но совпадает с ней только для углерода-12, поскольку атомная единица массы (а. е. м.) определяется сейчас как 1⁄12 массы атома 12С.
