
- •Теория химического строения органических соединений а.М. Бутлерова.
- •Изомерия.
- •Способы разрыва связей.
- •Классификация органических соединений.
- •Ациклические (нециклические) соединения.
- •Карбоциклические (алициклические) соединения.
- •Гетероциклические соединения.
- •Углеводы.
- •Алканы – предельные углеводороды.
- •Общая формула алканов
- •Циклоалканы.
- •Этиленовые углеводороды. Алкены. Олефины.
- •Диеновые углеводороды – алкодиены.
- •Каучук.
- •Алкины. Ацетиленовые углеводороды.
- •Реакции полимеризации и поликонденсации.
- •Ароматические углеводороды. Арены.
- •Правило ориентации в бензольном ядре.
- •Заместитель I рода; реагент электрофильный.
- •Заместитель I рода; реагент нуклеофильный.
- •Заместитель II рода; реагент нуклеофильный.
- •Заместитель II рода; реагент электрофильный.
- •Природные источники углеводородов и их переработка.
- •Природный газ.
- •Попутные газы.
- •Спирты.
- •Двухатомные спирты.
- •Трёхатомные спирты (глицерин).
- •Ароматические спирты.
- •Альдегиды и кетоны.
- •Реакции нуклеофильного присоединения.
- •Реакции замещения карбонильного кислорода.
- •Реакция конденсации.
- •Окисление.
- •Реакции полимеризации.
- •Реакция поликонденсации.
- •Реакции, идущие с участием радикала.
- •Карбоновые кислоты.
- •Сложные эфиры.
- •Жиры и масла.
- •Углеводы.
- •Аминокислоты.
- •Пептиды.
- •Гетероциклические соединения.
- •Пиридин.
- •Пиррол.
- •Пиримидин.
- •Нуклеиновые кислоты.
Диеновые углеводороды – алкодиены.
К диеновым углеводородам относятся органические соединения с общей формулой CnH2n – 2 в молекулах которых имеются две двойные связи.
Аллены – это такие алкодиены, у которых обе двойные связи находятся у одного атома углерода.
СН2 = С = СН2 пропандиен-аллен (положение 1,2)
Соединения такого типа неустойчивы.
Диеновые с сопряжёнными двойными связями (в положении 1,3)
СН2 = СН – СН = СН2 бутадиен-1,3; дивинил
Диены с изолированными двойными связями:
СН2 = СН – СН2 – СН2 – СН2 – СН = СН2 гептадиен-1,6
Соединения, в молекулах которых двойные связи удалены друг от друга не отличаются по своим свойствам от алкенов. Реакции присоединения у них идут так же как у алкенов, но в реакцию могут вступать две молекулы реагента. Двойные связи в этих соединениях реагируют независимо друг от друга, поэтому их называют изолированными.
Природа сопряжённых связей.
По данным современной электронной теории, методом рентгеноструктурного анализа выяснено, что межъядерное расстояние между 2 и углеродным атомом, уменьшено по сравнению с одинарной связью (1,48 А0):
1 2 3 4
С = С – С = С
0,136нм 0,148нм 0,136нм
Все атомы углерода и водорода находятся в одной плоскости. Атомы углерода находятся в Sp2-гибридизации, следовательно у каждого атома углерода находится по одному р-электрону, которые в гибридизации участия не приняли. Они взаимно перекрываются в плоскости перпендикулярной плоскости молекулы и образуют единое -электронное облако. Таким образом между 2 и 3 атомом углерода появляется дополнительное сцепление. Это есть сопряжение связей, оно приводит к выравниванию связей.
СН2 СН СН СН2
СН2 = СН – СН = СН2
Единое -электронное облако.
При действии реагента происходит перераспределение электронной плотности.
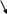

+ –
СН2 = СН – СН = СН2 + Н+ → СН2+ – СН = СН – СН3
СН2+ – СН = СН – СН3 + Br- → CH2Br – CH – CH – CH3
Химические свойства алкадиенов.
Присоединение галогенов.
а) CH2 = CH – CH = CH2 + Cl2 → CH2Cl – CH = CH – CH2Cl
дивинил 1,4-дихлорбутен-2
б) CH2Cl – CH = CH – CH2Cl + Cl2 → CH2Cl – CHCl – CHCl – CH2Cl
1,2,3,4-тетрахлорбутан
Гидрирование – присоединение водорода.
Ni, t0
CH2 = CH – CH = CH2 + H2 → CH3 – CH = CH – CH3
Ni, t0
CH3 – CH = CH – CH3 + H2 → CH3 – CH2 – CH2 – CH3
Гидрогалогенирование.
CH2 = CH – CH = CH2 + HBr → CH3 – CH = CH – CH2Br
Полимеризация идёт под действием катализаторов: щелочной металл или металлорганическое соединение.
Na
nCH2 = CH – CH = CH2 → ( – CH2 – CH = CH – CH2 – )n
Дивинил (СН2 = СН – СН = СН2) представляет собой бесцветный газ, сжижается при температуре – 50С.
СН2 = С – СН = СН2
|
СН3
Изопрен – бесцветная жидкость, температура кипения 340С.
Получение диеновых углеводородов.
Способ Лебедева 1932 г.
4250C, Al2O3, ZnO
2СН3 – СН2OH → CH2 = CH – CH = CH2 + 2H2O + H2
Дегидрирование бутана, содержащегося в нефтяных газах:
Al2O3, Cr2O3
СН3 – СН2 – СН2 – СН3 → СН2 = СН – СН2 – СН3 + СН3 – СН = СН – СН3 + H2
Бутен подвергают дальнейшему дегидрированию:
500-6000С, ZnO
С4Н8 → СН2 = СН – СН = СН2 + Н2
Изопрен в промышленности получают изомеризацией и дегидрированием пентанов фракции нефти:
Cat, t
CH3 – CH2 – CH2 – CH2 – CH3 → CH3 – CH – CH2 – CH3
|
CH3
t, Cr2O3, Al2O3
CH3 – CH – CH2 – CH3 → CH2 = C – CH = CH2 + 2H2
| |
CH3 CH3
Дегидротация 1,4-бутандиола:
Al2O3, t
СН2 – СН2 – СН2 – СН2 → СН2 = СН – СН = СН2 + 2Н2О
