
- •Теория химического строения органических соединений а.М. Бутлерова.
- •Изомерия.
- •Способы разрыва связей.
- •Классификация органических соединений.
- •Ациклические (нециклические) соединения.
- •Карбоциклические (алициклические) соединения.
- •Гетероциклические соединения.
- •Углеводы.
- •Алканы – предельные углеводороды.
- •Общая формула алканов
- •Циклоалканы.
- •Этиленовые углеводороды. Алкены. Олефины.
- •Диеновые углеводороды – алкодиены.
- •Каучук.
- •Алкины. Ацетиленовые углеводороды.
- •Реакции полимеризации и поликонденсации.
- •Ароматические углеводороды. Арены.
- •Правило ориентации в бензольном ядре.
- •Заместитель I рода; реагент электрофильный.
- •Заместитель I рода; реагент нуклеофильный.
- •Заместитель II рода; реагент нуклеофильный.
- •Заместитель II рода; реагент электрофильный.
- •Природные источники углеводородов и их переработка.
- •Природный газ.
- •Попутные газы.
- •Спирты.
- •Двухатомные спирты.
- •Трёхатомные спирты (глицерин).
- •Ароматические спирты.
- •Альдегиды и кетоны.
- •Реакции нуклеофильного присоединения.
- •Реакции замещения карбонильного кислорода.
- •Реакция конденсации.
- •Окисление.
- •Реакции полимеризации.
- •Реакция поликонденсации.
- •Реакции, идущие с участием радикала.
- •Карбоновые кислоты.
- •Сложные эфиры.
- •Жиры и масла.
- •Углеводы.
- •Аминокислоты.
- •Пептиды.
- •Гетероциклические соединения.
- •Пиридин.
- •Пиррол.
- •Пиримидин.
- •Нуклеиновые кислоты.
Общая формула алканов
СН4 – метан
С2Н6 – этан
С3Н8 – пропан
С4Н10 – бутан
С5Н12 – пентан
С6Н14 – гексан
С7Н16 – гептан
С8Н18 – октан
С9Н20 – нонан
С10Н22 – декан и т.д.
Первые четыре члена гомологического ряда метана имеют исторически сложившиеся названия.
– СН3 метил
– С2Н5 этил
– С3Н7 пропил
– С4Н9 бутил
– С5Н11 пентил
– С6Н13 гексил и т.д.
СН3 – СН – изопропил
|
СН3
СН3 – СН – СН2 – изобутил
|
СН3
СН3 – СН2 – СН – вторичный бутил
|
CH3
CH3
|
CH3 – C – третичный бутил
|
CH3
Физические свойства алканов.
Первые четыре члена гомологического ряда при обычных условиях – газы, остальные до С16Н34 – жидкости, а с С16Н34 и выше – твёрдые вещества. Температура плавления и температура кипения с увеличением числа углеродных атомов в основном повышается. Плотность тоже увеличивается. но все парафины легче воды и в ней не растворимы. Газообразные и твёрдые – не имеют запаха, а жидкие имеют характерный запах бензина и керосина.
Электронное строение этана и метана.
+6С 1 S2 2 S2 2 p2
2 S2 2p2
|
|
|
|
2 S1 2p3
|
|
|
|
Валентность углерода IV.
Атом углерода находится в Sp3-гибридизации.
Гибридное облако
имеет форму
неправильной восьмёрки.
Гибридные облака атома углерода направлены к вершинам тетраэдра и валентный угол равен 109028.
Н Образуются в молекуле
∙∙ метана: четыре равноценные
Н : С : Н связи С – Н.
∙∙ – связь характеризуется
Н энергией и межъядерным
СН4 – метан расстоянием.
Н Н
∙∙ ∙∙
Н : С : С : Н Е(С–С) = 83,6 ккал/моль
∙∙ ∙∙
Н Н Е(С–Н) = 98,8 ккал/моль
С2Н6 – этан
Межъядерное расстояние С – С = 1,548 А0, так как валентный угол 109028, поэтому углеродная цепь принимает зигзагообразную форму:
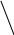


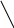

 109028
109028
Химические свойства алканов.
Ковалентные связи, образуемые каждым атомом углерода, малополярны. Поэтому алканы вступают только в реакции – замещения, протекающие по радикальному механизму.
Реакция галогенирования протекает в жёстких условиях (высокая температура, освещение):
h
CH4 + Cl2 → HCl + CH3Cl (хлорметан)
СH3Cl + Cl2 → HCl + CH2Cl2 (хлористый метил)
CH2Cl2 + Cl2 → HCl + CHCl3 (хлороформ)
CHCl3 + Cl2 → HCl + CCl4 (тетрахлоруглерод)
Механизм реакции радикальный.
а) Молекула хлора под действием кванта света распадается на атомы – радикалы:
∙∙ ∙∙ h ∙∙ ∙∙
: Cl : Cl : → : Cl ∙ + ∙ Cl :
∙∙ ∙∙ ∙∙ ∙∙
б) Радикал – активная частица обладает повышенной кинетической энергией – действует на молекулу метана и наблюдается цепная реакция.
Н Н
∙∙ ∙∙ ∙∙ ∙∙
: Cl ∙ + Н : C : Н → Н : Cl : + Н : C ∙
∙∙ ∙∙ ∙∙ ∙∙
Н Н (радикал метил)
Радикал метил действует на молекулу хлора:
Н Н
∙∙ ∙∙ ∙∙ ∙∙ ∙∙ ∙∙
Н : C ∙ + : Cl : Cl : → Н : C : Cl : + : Cl ∙
∙∙ ∙∙ ∙∙ ∙∙ ∙∙ ∙∙ (радикал хлора)
Н Н
И так далее, пока вся смесь хлора и метана не прореагирует.
Частицы, имеющие непарный электрон, называются свободными радикалами. Реакции, в результате которых происходит цепь последовательных превращений, называются цепными реакциями. в разработке цепных реакций большую роль сыграли труды академика лауреата Нобелевской премии Н.Н. Семёнова. Атомы брома обладают наибольшей избирательностью, атомы хлора менее избирательны. Если в молекуле алкана есть третичный атом углерода, то реакция галогенирования происходит в основном по нему; если нет третичного, то реакция замещения происходит у вторичного атома углерода, если нет вторичного, то у первичного. Причём, если в реакцию с алканом, имеющим третичный атом углерода вступает бром, то реакция идёт только у этого атома, а если хлор, то реакция идёт у третичного и у вторичного атома углерода, но у третичного преимущественнее. Br
h |
CH3 – CH2 – CH – CH3 + Br2 → CH3 – CH2 – C – CH3 + HBr
| |
CH3 CH3
Cl Cl
h | |
CH3 – CH2 – CH – CH3 + Cl2 → CH3 – CH2 – C – CH3 + CH3 – CH – CH – CH3
| | |
CH3 CH3 CH3
(70%) (30%)
+ HCl
Br
h |
CH3 – CH2 – CH3 + Br2 → CH3 – CH – CH3 + HBr
Cl Cl
h | |
CH3 – CH2 – CH3 + Cl2 → CH3 – CH – CH3 + CH3 – CH2 – CH2 + HCl
(70%) (30%)
Реакция нитрования – реакция Коновалова.
t0
R – H + HO – NO2 → R – NO2 + H2O
Механизм реакции Коновалова происходит по свободнорадикальному механизму:
t0
HO – NO2 → HO – + NO2 –
H3C – H + ∙ NO2 → HNO2 + CH3 ∙
HNO2 + HNO3 → H2O + N2O4
N2O4 2 ∙ NO2
CH3 ∙ + ∙ NO2 → CH3 – NO2
Нитрование происходит при высокой температуре:
t0
C2H6 + HO – NO2 → C2H5 – NO2 + H2O
нитроэтан
В промышленности часто применяют парафазное нитрование при повышенной температуре, например, нитрование метана:
2500С
CH4 + HO – NO2 → CH3 – NO2 + H2O
пар нитрометан
используется в производстве взрывчатых веществ.
Реакция сульфирования.
При обычной температуре концентрированная серная кислота (H2SO4) на предельные углеводороды не действует. Реакция сульфирования протекает при нагревании. Сульфирующими свойствами обладает олеум:
C5H12 + HO – SO3H → C5H11 – SO3H + H2O
серная кислота пентосульфокислота
Реакции окисления.
Предельные углеводороды при обычных условиях не окисляются. Окисление проводят при повышенной температуре и введении катализаторов кислородом:
Cat; t0
2СН4 + О2 → 2СН3ОН
метанол
О
Cat; t0 //
CH4 + O2 → H – C + H2O
\
Н
метаналь
Окислительным пиролизом из метана получают ацетилен:
14000C
4СН4 + 2 О2 → CH ≡ CH + 6H2 + CO2 + 2H2O
ацетилен
Полное окисление – горение:
С3Н8 + 5О2 → 3СО2 + 4Н2О
Дегидрирование – отщепление водорода.
Pt
СН3 – СН2 – СН3 → СН2 = СН – СН3 + Н2
Крекинг предельных углеводородов осуществляется при высокой температуре:
15000С
2СН4 → CH ≡ CH + 3H2
400 - 5000С
2СН4 → CH2 = CH2 + 2H2
10000С
СН4 → C + 2H2
Cat; t0
С8Н16 → С4Н8 + С4Н10
Изомеризация.
AlCl3; t0
СН3 – СН2 – СН2 – СН3 → СН3 – СН – СН3
|
CH3
Циклизация.
Ni, t0
СН3 – СН2 – СН2 – СН2 – СН3 → + Н2
А
 роматизация.
роматизация.
 Pt,
Ni,
t0
Pt,
Ni,
t0
СН3 – СН2 – СН2 – СН2 – СН3 → + 4H2
Получение алканов.
I. Источниками алканов и циклоалканов в промышленности является нефть, природный газ и каменный уголь.
II. Синтетические способы получения.
Взаимодействием галогенопроизводных с металлическим натрием. Эта реакция открыта Вюрцем, а механизм разработан Шорыгиным:
CH3Cl + 2Na + CH3 – CH2 – Cl → CH3 – CH2 – CH3 + 2NaCl
Каталитическое гидрирование этиленовых углеводородов:
Ni, Pt
CH2 = CH2 + H2 → CH3 – CH3
Сплавление солей карбоновых кислот с гидроксидом натрия:

 t0
t0
C H3 – COONa + NaOH → CH4 + Na2CO3
Восстановление галогеноалканов:
C2H5I + HI → C2H6 + I2
Взаимодействие галогеноалканов с металлами и разложением металлоорганических соединений водой:
эфир
С2Н5Br + Mg → C2H5MgBr
бромистый этил магния
OH
|
С2Н5MgBr + H2O → Mg – Br + C2H6
Метан, может быть получен в результате соединения водорода и углерода при температуре 5000С в присутствии катализатора – никеля:
t, Ni
С + Н2 → СН4
Метан, можно получить на основе водяного газа. Этот способ имеет промышленное значение и называется синтезом Орлова – Фишера – Тропша:
Ni, 3000C
CO + H2 → CH4 + H2O
Ni, 4000C
CO2 + 4H2 → CH4 + 2H2O
III. В лабораторных условиях метан можно получить из карбида алюминия:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Применение алканов.
Метан широко применяется как топливо.
Метан применяется для получения водорода, ацетилена, сажи, метанола, формальдегида:
10000С
СН4 → 2Н2 + С
При окислении углеводородов с С20Н42 и далее получают мыло, моющие средства, смазочные материалы, лаки, эмали.
Жидкие углеводороды используются как горючее (бензин, керосин).
Конверсия метана водяным паром приводит к образованию СО и Н2, а эта смесь служит для получения синтетического бензина, метилового спирта и др.:
8000С
СН4 + Н2О → СО + 2Н2
Окисление метана воздухом в присутствии катализаторов получают метиловый спирт, формальдегид и муравьиную кислоту:
О О
О2 О2 // [O] //
СН4 → СН3 – ОН → Н – С → Н – С
\ \
Н ОН
Метан применяют для получения синтез-газа:
2СН4 + О2 → 2СО + 4Н2
Получают синильную кислоту пиролизом смеси метана и аммиака в присутствии кислорода:
2СН4 + 2NH3 + 3O2 → 2HCN + 6H2O
Хлорпроизводные метана применяются:
CH3Cl – хлористый метил – в холодильных установках.
CHCl3 – хлороформ – растворитель.
CCl4 – четырёххлористый углерод – растворитель.
