
- •2.Химические реакции, фазовые и структурные превращения. Основные типы и классы химических соединений.
- •3.Классы неорганических соединений. Химические и структурно-графические формулы, способы получения соединений.
- •4.Стехиометрические законы (шесть) и их современное толкование.
- •5. Химический эквивалент элемента, оксида, гидроксида и соли. Молярная масса эквивалента, молярный объём эквивалента газа. Общая и частные формулы закона эквивалентов.
- •6.Строение атома. Ядро и электроны, протоны и нейтроны, их заряд и масса. Квантовый характер излучения и поглощения энергии. Уравнение Планка. Представление об атомных спектрах.
- •7. Корпускулярно-волновая природа движущихся микрочастиц. Уравнение де Бройля. Принцип неопределенности. Понятие о волновой функции и атомной орбитали. Квантовые числа электронов в атоме.
- •9. Периодический закон и система элементов д.И. Менделеева, их развитие и значение. Закон Мозли. Структура периодической системы и её связь со строением атомов. Электронные аналоги.
- •10. Периодичность физических и химических свойств элементов. Энергия ионизации, сродство к электрону, электроотрицательность, атомный радиус.
- •12. Метод валентных связей. Гибридные орбитали и связи. Валентные углы. Строение молекул BeF2, BeF3, cCl4, sf6, h2o и nh3.
- •13. Кратность (порядок) связи. Сигма- и Пи-связи, схемы перекрывания атомных орбиталей и прочность связей. Полярные связи и молекулы.
- •15. Энергетические диаграммы образования молекул n2 и o2. Кратность связи и магнитные свойства.
- •16. Ионная связь и её свойства. Строение ионных кристаллов типа CsCl, NaCl, ZnS (сфалерит) и CaF2 (флюорит).
- •17. Металлическая связь и её свойства. Кристаллические структуры металлов типа вольфрама, меди и магния. Координационные числа и плотность упаковки атомов.
- •19. Агрегатные состояния вещества и их характеристика. Плазма. Стекла и аморфные вещества. Понятие о ближнем и дальнем порядках.
- •20. Энергетический (тепловой) эффект изохорного и изобарного химических процессов. Стандартная энтальпия образования химического соединения. Закон Гесса и следствия из него.
- •23. Направление химической реакции. Понятие о свободной энергии Гиббса и её изменении как движущей силы изобарного процесса. Стандартное изменение энергии Гиббса при химической реакции.
- •24. Скорость гомогенной реакции. Средняя и истинная скорость реакции. Закон действия масс. Константа скорости реакции. Понятие о молекулярности и порядке реакции.
- •25. Зависимость скорости реакции от температуры.Правило Вант-Гоффа. Понятие об активных частицах и энергии активации. Уравнение Аррениуса.
- •27. Катализаторы химических реакций. Представление о механизме катализа. Специфичность катализа.Примеры и роль каталитических процессов при химической переработке древесного сырья.
- •28. Растворы. Процессы при образовании растворов. Идеальные и реальные растворы. Гидраты и сольваты.
- •29. Концентрации раствора и способы её выражений (массовые доля и процент, молярная доля, молярность, нормальность, молярность). Плотность раствора.
- •30. Растворимость газов, жидкостей и твёрдых веществ в жидкостях. Закон Генри. Ненасыщенные, насыщенные и пересыщенные растворы.
- •31. Растворы неэлектролитов. Понятие об осмосе и осмотическом давлении. Закон Вант-Гоффа. Изотонические растворы. Роль осмоса в жизни растений.
- •32. Давление насыщенного пара растворителя над раствором нелетучего растворенного вещества. Закон Рауля. Температуры замерзания и кипения растворов (влияние концентрации).
- •33. Растворы электролитов. Сильные и слабые электролиты. Связь кажущейся степени диссоциации с изотоническим коэффициентом. Понятие об активности и ионной силе раствора.
- •34. Обменные реакции между ионами. Молекулярные и ионные уравнения реакций. Условия необратимости ионных реакций.
- •35. Степень и константа диссоциации слабого электролита. Закон разбавления Оствальда. Ступенчатая диссоциация электролита. Влияние общих ионов на диссоциацию слабых электролитов.
- •37. Растворимость малорастворимых твердых электролитов в воде. Произведение растворимости (пр). Влияние общих ионов на растворимость. Амфотерные гидроксиды и оксиды.
- •38. Гидролиз солей по катиону, аниону, катиону и аниону. Ступенчатый гидролиз. Необратимый совместный гидролиз солей. Уравнения реакций.
- •39. Степень и константа гидролиза солей. Подавление и усиление гидролиза. Изменение водородного показателя при гидролизе. Применение гидролизующих солей при химической переработке древесины.
- •40. Протолиты и протолитические равновесия. Сродство к протону. H-кислоты и основания. Влияние природы растворителя на кислотно-основные свойства веществ
15. Энергетические диаграммы образования молекул n2 и o2. Кратность связи и магнитные свойства.
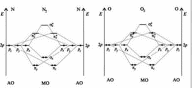
КРАТНОСТЬ СВЯЗИ - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной 2/4467.html"химической связи
16. Ионная связь и её свойства. Строение ионных кристаллов типа CsCl, NaCl, ZnS (сфалерит) и CaF2 (флюорит).
Ионная связь — прочная C"химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) C"электроотрицательностей, при которой общая "электронная параполностью переходит к атому с большей электроотрицательностью.
св-ва: ненасыщаемость, дальнодействие, ненаправленность.
17. Металлическая связь и её свойства. Кристаллические структуры металлов типа вольфрама, меди и магния. Координационные числа и плотность упаковки атомов.
Металлическая связь — C"химическая связь, обусловленная наличием относительно свободных %AD%D%BB%D%B%D%BA%D%82%D%80%D%BE%D%BD"электронов. Характерна как для чистых %C%D%B%D%82%D%B%D%BB%D%BB"металлов, так и их %A%D%BF%D%BB%D%B%D%B"сплавов и B"интерметаллических соединений. Электропроводность и теплопроводность. Эти свойства свидетельствуют о том, что валентные электроны способны свободно перемещаться в пределах кристаллической решетки.
Координационное число (в F"химии и F"кристаллографии) — характеристика, которая определяет число ближайших частиц (%98%D%BE%D%BD"ионов или %90%D%82%D%BE%D%BC"атомов) в "молекуле или %A%D%80%D%B%D%81%D%82%D%B%D%BB%D%BB"кристалле.
Количество атомов и размер ячейки определяют плотность упаковки атома. Плотность упаковки атома вдоль разных атомных плоскостей внутри кристалла различна.
18. Водородная и меж- и внутримолекулярная связь. Представление о природе, длине и прочности водородных связей. Влияние водородных связей на температуры плавления и кипения веществ (H20, HF, NH3), на прочность волокнистых материалов.
Водородная связь — форма %90%D%81%D%81%D%BE%D%86%D%B%D%B%D%86%D%B%D%F_(%D%85%D%B%D%BC%D%B%D%F)"ассоциации между C"электроотрицательным атомом и атомом водорода H, связанным C"ковалентно с другим%C"электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать %90%D%B%D%BE%D%82"N, %A%D%B%D%81%D%BB%D%BE%D%80%D%BE%D%B"O или %A%D%82%D%BE%D%80"F. Водородные связи могут быть"межмолекулярными или "внутримолекулярными.
Внутримолекулярная водородная связь является преобладающей только для разбавленных растворов ( 0 05 М) эфиров. По мере увеличения концентрации возрастают межмолекулярные водородные связи эфиров. Количественное изучение этой связи чрезвычайно затруднено из-за наличия в объеме жидкости единой сетки водородных связей
Межмолекулярная водородная связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный элемент - фтор, кислород, азот, реже хлор и сера.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность%92%D%BE%D%B%D%BE%D%80%D%BE%D%B%D%BD%D%B%D%F_%D%81%D%B%D%F%D%B%D%C", её распространенность и важность, особенно в органических соединениях%92%D%BE%D%B%D%BE%D%80%D%BE%D%B%D%BD%D%B%D%F_%D%81%D%B%D%F%D%B%D%C"], а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время в рамках "теории молекулярных орбиталей водородная связь рассматривается как частный случай C"ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровыхчетырёхэлектронных связей (например, -H•••[F-H•••F]-).
Энергия водородной связи возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, О или N. Энергия связи (кДж/моль) возрастает в ряду
Несмотря на высокую ЭО у хлора, водородная связь –Н···Cl– относительно слабая из-за большого размера атома хлора
