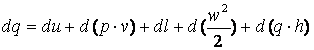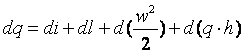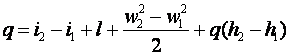- •Термодинамическая система : открытая, закрытая. Виды термодинамических процессов в термодинамической системе.
- •2. Параметры состояния вещества и теплофизические функции, их еденицы измерения.
- •3.Классическая модель идеального газа. Уравнение Клапейрона-Менделеева.
- •Основное уравнения модели идеального газа
- •5. Фазовый переход на p-V диагремме согласно уравнению Ван-дель-Ваальса. Метастабильное состояние
- •7.Агрегатное состояние вещества. Поведение молекул в разных агрегатных состояниях. Энергия одной молекулы газа
- •8. Энергия
- •9.Энтальпия
- •10.Энтропия
- •11. 1 Закон
- •Адиабатный
- •Работа, затрачиваемая на сжатие воздуха в компрессоре, есть техническая работа, определяемая выражением
- •Закон о суммарном давлении смеси газов[править | править исходный текст]
- •Закон о растворимости компонентов газовой смеси[править | править исходный текст]
- •Процессы
- •Применение[править | править исходный текст]
- •Обратный цикл Ренкина[править | править исходный текст]
- •Процесс получения водяного пара из воды
10.Энтропия
Энтропи́я (от др.-греч. ἐντροπία — поворот, превращение) — в естественных науках мера неупорядоченности системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности ивариативности исторического процесса).
Энтропия в информатике — степень неполноты, неопределённости знаний.
Энтропия — мера неупорядоченности системы.
Явление, обратное энтропии, именуется негэнтропией.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при замкнутых обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]() ,
,
где ![]() —
приращение энтропии;
—
приращение энтропии; ![]() —
минимальная теплота, подведённая к
системе;
—
абсолютная температура процесса.
—
минимальная теплота, подведённая к
системе;
—
абсолютная температура процесса.
Термодинамическая энтропия — термодинамическая функция, характеризующая меру неупорядоченности термодинамической системы, то есть неоднородность расположения и движения её частиц.
11. 1 Закон
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Изменение
полной энергии системы в квазистатическом
процессе равно
количеству теплоты ![]() ,
сообщённому системе, в сумме с изменением
энергии, связанной с количеством
вещества
,
сообщённому системе, в сумме с изменением
энергии, связанной с количеством
вещества ![]() при химическом
потенциале
при химическом
потенциале ![]() ,
и работы
,
и работы ![]() [3],
совершённой над системой внешними
силами иполями,
за вычетом работы
[3],
совершённой над системой внешними
силами иполями,
за вычетом работы ![]() ,
совершённой самой системой против
внешних сил
,
совершённой самой системой против
внешних сил
![]() .
.
Для
элементарного количества теплоты
,
элементарной работы ![]() и
малого приращения
и
малого приращения ![]() внутренней
энергии первый закон термодинамики
имеет вид:
внутренней
энергии первый закон термодинамики
имеет вид:
![]() .
.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно
заметить, что
и ![]() являются полными
дифференциалами,
а
и
—
нет.
являются полными
дифференциалами,
а
и
—
нет.
Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии.
12.
Используя понятие энтальпии, первый закон термодинамики можно записать в виде
|
|
При количественном анализе процессов часто используется математическая запись первого закона термодинамики через энтальпию:
|
(2.13) |
|
(2.14) |
|
(2.15) |
|
(2.16) |
|
|
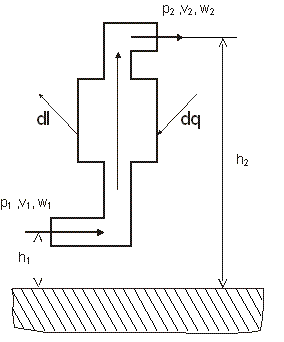
13. Уравнение первого закона термодинамики для движущегося рабочего тела
Уравнение первого закона для единицы массы стационарного потока (т. е. потока, параметры которого в любом сечении со временем не изменяются) можно вывести с помощью модели, показанной на рис. 3.2.
|
Рис. 3.2. К выводу уравнения первого закона термодинамики для движущегося рабочего тела |
|
(3.9) |
Так как по определению u+p*v=i, полученное выражение можно переписать следующим образом
|
|
|
(3.10) |
14.
Дросселирование (от нем. drosseln — душить) — понижение давления газа или пара при протекании через сужение проходного канала трубопровода — дроссель, либо через пористую перегородку.
Дросселирование является близким к идеальному осуществлением процесса Джоуля-Томсона. Дросселирование можно рассматривать[1] как изоэнтальпийныйквазиравновесный процесс и проводить, основываясь на выражении
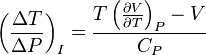
дифференциального эффекта Джоуля-Томсона, интегрирование следующим образом:
 — интегральный
эффект Джоуля-Томсона.
— интегральный
эффект Джоуля-Томсона.
15.