
- •Катализ и катализаторы. Гомогенные и гетерогенные катализаторы. Влияние катализаторов на величину энергии активации и константу скорости реакции.
- •35.Растворы. Классификация дисперсных систем: истинные растворы, коллоидные растворы, грубодисперсные системы
- •Н Растворимость веществ. Влияние природы растворяемого вещества и растворителя, температуры и давления на растворимость газов, твердых и жидких веществ.
- •38 Концентрация растворов. Способы выражения состава растворов.
- •Второй закон Рауля
- •Теория Аррениуса
- •[Править]Теория Брёнстеда
- •[Править]Теория кислот и оснований Льюиса
- •Реакции ионного обмена в растворах. Обратимые и необратимые реакции, признаки необратимости реакций.
- •Труднорастворимые электролиты. Равновесие между осадком и насыщенным раствором. Произведение растворимости и растворимость веществ.
- •46.Константа гидролиза. Степень гидролиза, связь степени гидролиза с константой гидролиза и концентрацией раствора. Факторы, определяющие глубину гидролиза солей. Совместный гидролиз.
- •Классификация и номенклатура комплексных соединений. Основные типы комплексных соединений.
Второй закон Рауля
Тот же Рауль экспериментально доказал, что
повышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть,
ΔTкип/зам= Kэб/кр · bв-ва, где
Kэб/кр — соответственно эбулиоскопическая (от лат. ebullire — «кипеть» и др.-греч. σκοπέω — «наблюдаю») и криоскопическая (относится к замерзанию) константы, характерные для данного растворителя;
bв-ва — моляльность вещества в растворе.
Электролитическая диссоциация ( ионизация). Факторы, определяющие склонность веществ к диссоциации. Механизм диссоциации веществ с различным характером химической связи . Гидратация ионов в растворе, ион гидроксония.
Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении.Факторы, определяющие склонность веществ к диссоциации: полярность и энергия связи, поляризуемость молекул растворенного вещества, полярность молекул растворителя, характер взаимодействия растворенного вещества и растворителя. Существенным является вопрос о механизме электролити ческой диссоциации.
Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения.В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых обра
зованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной
молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягива
ются к положительному полюсу молекулы,а положительными полюса
ми - к отрицательному полюсу. В результате этого взаимодействия
связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула
превращается в ионную и затем легко образуются гидратированные ионы ![]() . Диссоциация полярных молекул может быть полной
или частичной.
. Диссоциация полярных молекул может быть полной
или частичной.
Таким образом, электролитами являются соединения с ионной или полярной связью - соли, кислоты и основания. И диссоциировать на ионы они могут в полярных растворителях.
Сильные и слабые электролиты. Степень диссоциации. Равновесие в растворах слабых электролитов. Константа диссоциации. Связь константы диссоциации со степенью диссоциации и концентрацией раствора.
Исходя из степени диссоциации все электролиты делятся на две группы
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как:HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратнаконстанте ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
Основные представления теории растворов сильных электролитов. Истинная и кажущаяся степень диссоциации в растворах. Концентрация и активность ионов. Коэффициент активности. Ионная сила растворов электролитов.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учетом различных взаимодействий между ними в растворе, то есть с учетом отклонения поведения системы от модели идеального раствора. Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
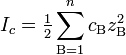 ,
,
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
Классическая теория электролитической диссоциации применима лишь к разбавленным растворам слабых электролитов. Сильные электролиты в разбавленных растворах диссоциированы практически полностью, поэтому представления о равновесии между ионами и недиссоциированными молекулами лишено смысла. Согласно представлениям, выдвинутым в 20—30-х гг. 20 в. В. К. Семенченко (СССР), Н. Бьеррумом (Дания), Р. М. Фуоссом (США) и др., в растворах сильных электролитов при средних и высоких концентрациях образуются ионные пары и более сложные агрегаты. Современные спектроскопические данные показывают, что ионная пара состоит из двух ионов противоположного знака, находящихся в контакте («контактная ионная пара») или разделённых одной или несколькими молекулами растворителя («разделённая ионная пара»). Ионные пары электрически нейтральны и не принимают участия в переносе электричества. В сравнительно разбавленных растворах сильных электролитов равновесие между отдельными сольватированными ионами и ионными парами может быть приближённо охарактеризовано, аналогично классической теории электролитической диссоциации, константой диссоциации (или обратной величиной — константой ассоциации). Это позволяет использовать вышеприведённое уравнение для расчёта соответствующей степени диссоциации, исходя из экспериментальных данных.
В простейших случаях (большие одноатомные однозарядные ионы) приближённые значения константы диссоциации в разбавленных растворах сильных электролитов можно вычислить теоретически, исходя из представлений о чисто электростатическом взаимодействии между ионами в непрерывной среде — растворителе.
Кислоты, основания, амфотерные гидроксиды, соли с точки зрения теории электролитической диссоциации. Диссоциация солей средних, кислых, основных. Ступенчатая диссоциация. Теории кислот и оснований Аррениуса, Бренстеда,Льюиса.
Основания. Название "основание" первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов. Примеры: NaOH - гидроксид натрия (едкий натр), KOH - гидроксид калия (едкое кали), Ca(OH)2 - гидроксид кальция (гашёная известь). Основания, которые хорошо растворяются в воде, называются щелочами, К ним относятся гидроксиды щелочных и щелочно-земельных металлов. С точки зрения теории электролитической диссоциации основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-. В общем виде уравнение электролитической диссоциации основания имеет вид: Основание -> Катион основания + Гидроксид - ион
NaOH |
Кислоты.Кислоты исторически получили своё название из-за кислого вкуса водных растворов тактх веществ, как хлороводород или уксусная кислота. С точки зрения теории электролитической диссоциации кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+. В общем виде уравнение электролитической диссоциации кислоты имеет вид: Кислота -> Катион водорода + Анион кислотного остатка
H2SO4 2H+ + SO42- CH3COOH H+ = CH3COO- |
Соли. С точки зрения теории электролитической реакции соли - это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка. В общем виде уравнение электролитической диссоциации солей имеет следующий вид: Соль -> Катион основания + Анион кислотного остатка
BaCl2 Ba2+ + 2Cl- K2CO3 K+ + CO32- |
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример:
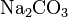 ,
, 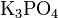 .
.Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример:
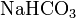 ,
, 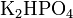 .
.Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Пример:
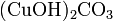 .
.
