
- •Катализ и катализаторы. Гомогенные и гетерогенные катализаторы. Влияние катализаторов на величину энергии активации и константу скорости реакции.
- •35.Растворы. Классификация дисперсных систем: истинные растворы, коллоидные растворы, грубодисперсные системы
- •Н Растворимость веществ. Влияние природы растворяемого вещества и растворителя, температуры и давления на растворимость газов, твердых и жидких веществ.
- •38 Концентрация растворов. Способы выражения состава растворов.
- •Второй закон Рауля
- •Теория Аррениуса
- •[Править]Теория Брёнстеда
- •[Править]Теория кислот и оснований Льюиса
- •Реакции ионного обмена в растворах. Обратимые и необратимые реакции, признаки необратимости реакций.
- •Труднорастворимые электролиты. Равновесие между осадком и насыщенным раствором. Произведение растворимости и растворимость веществ.
- •46.Константа гидролиза. Степень гидролиза, связь степени гидролиза с константой гидролиза и концентрацией раствора. Факторы, определяющие глубину гидролиза солей. Совместный гидролиз.
- •Классификация и номенклатура комплексных соединений. Основные типы комплексных соединений.
28.Факторы, определяющие направление самопроизвольного протекания химических процессов (энергетический и энтропийный).Энтропия. Второе и третье начала термодинамики. Определение изменения энтропии в ходе реакции.
Суть второго начала состоит в том, что оно определяет направление самопроизвольного протекания процессов, в том числе и химических реакций.
Самопроизвольным называется процесс, который протекает самостоятельно без воздействия внешних факторов.
Например, если соединить два сосуда — заполненный газом и пустой, то газ самопроизвольно заполнит весь объем. Взаимодействие металлического натрия с водой при н. у. также происходит самопроизвольно. Обратные процессы можно осуществить, оказав внешнее воздействие. Для исследователя необходимо иметь критерий, с помощью которого можно было бы предсказать направление самопроизвольного протекания процесса.
Существует еще одна функция состояния, которая с учетом первого начала термодинамики позволяет предсказать направление протекания процесса в изолированных системах. Такой функцией состояния является энтропия (S).
Интерпретировать энтропию можно как с точки зрения макроскопического состояния системы, так и с точки зрения микроскопического.
Если рассматривать систему в целом, то в обратимом процессе, протекающем при постоянной температуре, изменение энтропии будет равно:
S
=

Для необратимого процесса это равенство превращается в неравенство:
S>
Второй закон термодинамики:В изолированной системе самопроизвольно протекают только те процессы, которыесопровождаются увеличением энтропии.
Третий закон термодинамики: Энтропия химических веществ при абсолютном нуле равна нулю. Энтропия – мера беспорядка.
29.Энергия Гиббса. Соотношение между энергией Гиббса ,энтальпией и энтропией. Стандартная энергия Гиббса образования вещества. Изменение энергии Гиббса в ходе реакции и направление самопроизвольного протекания реакции.
Энергия Гиббса: РазностьНТ - ТSТ <0, представляет собой новую функцию состояния, так как является разностью двух функций состояния: энтальпии и энтропии, умноженной на температуру, которая, в свою очередь, подпадает под определение функции состояния. Называется эта функция свободной энергией Гиббса (или изобарно-изотермическим потенциалом), обозначается буквой Gи имеет размерность кДж/моль.
Изменение свободной энергии в процессе равно:G = Н-ТS -ST
Согласно первому началу термодинамики, изменение внутренней энергии системы равно сумме теплоты, выделенной или поглощенной в результате химической реакции или другого процесса, и полной работы, совершенной системой . Полная работа процесса, протекающего при постоянных давлении и температуре, складывается из работы против сил давления и полезной работы:
А = - рV+Аполезн
G = U - ТS+рV
Изменения свободной энергии Гиббса:
G = - рV + Аполезн + ТS+рV - ТS.
Физический смысл изменения свободной энергии Гиббса:Изменение свободной энергии равно максимальной полезной работе, которую совершает система в изобарно-изотермическом процессе.
Иными словами, это энергия, которую можно «изъять» из системы в виде полезной работы. Поэтому она и называется «свободной».
Понятие свободной энергии Гиббса является результатом единства первого и второго законов термодинамики.
Если изменение свободной энергии меньше нуля, то реакция протекает самопроизвольно.Если ∆G = 0, начальные и конечные состояния могут существовать в равновесии. Если же изменение свободной энергии больше нуля, самопроизвольное протекание реакции невозможно. Самопроизвольно протекает обратная реакция.стандартные изменения энтальпии и энтропии. Возможны четыре случая.
Первый: когда изменение энтальпии отрицательно, а изменение энтропии положительно, то изменение свободной энергии всегда отрицательно. Такие реакции самопроизвольно протекают в прямом направлении. Примером может служить реакция горения черного пороха, которая протекает по следующему суммарному уравнению:
2 КNO3 + 3С + S =N2 + ЗСО2 + К2S
Второй: когда изменение энтальпии положительно, а изменение энтропии отрицательно. Эти реакции в прямом направлении самопроизвольно не идут, самопроизвольно протекает обратная реакция. В качестве примера приведем реакцию термического разложения хлористого водорода на простые вещества:
2 НС1Г = Н2,г + С12,г
Изменение энтальпии этой реакции равно двум энергиям разрыва связей Н—С1 и составляет 92,3 х 2 = 184,6 кДж. Изменение энтропии равно:
rS0298 = S0298 H2 + S0298 Cl2 - 2 S0298 HCl = 130,6 + 233 - 2ּ186,7 = -19.8 Дж/К
rG0298 = 184,6 - 298× (-19,8) ×10~3 = 190,5 кДж >О
Третий: когда как изменение энтальпии, так и энтропии отрицательны. В этом случае направление самопроизвольного процесса определяется температурой. При низкой температуре самопроизвольно идет прямая реакция, так как по абсолютной величине изменение энтальпии больше произведения температуры на изменение энтропии. Например, в реакции образования хлорида аммония из газообразных хлористого водорода и аммиака:
NН3,г + НС1Г =NH4С1К
гH0298 = fH0298NH4Cl - fH0298 Cl2 - fH0298NH3 = -315,4-(-92,3)-(-46,2) = -176,9 кДж
rS = S0298 NH4Cl - S0298 NH3 - S0298 HCl = 94,6 – 192,5 – 186,7 = -284,6 Дж/К
Т. к. при равновесии изменение свободной энергии равно нулю (G = 0), то температура, при которой система находится в равновесии, равна
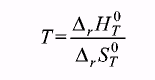
и
Т
=
 = 621,6К
= 621,6К
Четвертый: когда изменение энтальпии и энтропии положительные. Направление реакции также зависит от температуры: при низкой температуре самопроизвольно будет протекать обратная реакции, а при высокой — прямая.
Это характерно для реакций диссоциации:
N2O4 2 N02
Для данной реакции г H0298 = 57,З кДж; г S0298 = 176,6 Дж/К и rG°298 = 4,7 кДж.
Температура, при которой устанавливается состояние равновесия: Т= 324,5 К. Ниже этой температуры самопроизвольно протекает реакция димеризации, а выше — реакция диссоциации.
Следует отметить, что стандартные величины образования изобарно-изотермического потенциала простых веществ (так же как и стандартные энтальпии образования простых веществ) принимаются равными нулю. Например: ΔfG0(H2) = 0.
30.Скорость химической реакции. Гомогенные и гетерогенные реакции. Факторы,определяющие скорость химических реакций. Закон действия масс. Константа скоростиреакции. Влияние температуры на скорость химических реакций. Энергия активации,активированный комплекс. Энергетическая диаграмма и тепловой эффект реакции. Уравнение Аррениуса.
Скорость хим реакции-это число элем-х актов реакции, происход-х в ед. времени, в едV (для гомог-х), или на единице пов-ти раздела фаз (для гетер-х). Гомог-е – протек –т в однородной среде( в рас-ре, газ-й смеси). Гетер-е – протек на пов-ти раздела фазы. Напр: тв вещ-во – жидкость или газ. Факторы, влияющие на скор: 1. Природа реаг-х вещ-в; 2. Концентр-я; 3. Темп-ра; 4. Катализ-р; 5. Скорость диффузии(для гетер-х). Закон действия масс: при пост-й темп-ре скороть элем-й хим-й реакции прямопропорц-на концентр-иреаг-х вещ-в.Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа
скорости реакции зависит от температуры,
от природы реагирующих веществ, но не
зависит от их концентрации.Из
качественных соображений понятно, что
скорость реакций должна увеличиваться
с ростом температуры, т.к. при этом
возрастает энергия сталкивающихся
частиц и повышается вероятность того,
что при столкновении произойдет
химическое превращение. Для количественного
описания температурных эффектов в
химической кинетике используют два
основных соотношения - правило Вант-Гоффа
и уравнение Аррениуса.Правило
Вант-Гоффа заключается
в том, что при нагревании на 10 оС
скорость большинства химических реакций
увеличивается в 2 4
раза.Энергия
активации—
минимальное количество энергии,
которое требуется сообщить системе (в
химии выражается в джоулях намоль),
чтобы произошла реакция.
Термин введён Сванте
Августом Аррениусом в 1889.
Типичное обозначение энергии
реакции Ea.Уравнение
Аррениуса устанавливает
связь между энергией активации и
скоростью протекания реакции:
4
раза.Энергия
активации—
минимальное количество энергии,
которое требуется сообщить системе (в
химии выражается в джоулях намоль),
чтобы произошла реакция.
Термин введён Сванте
Августом Аррениусом в 1889.
Типичное обозначение энергии
реакции Ea.Уравнение
Аррениуса устанавливает
связь между энергией активации и
скоростью протекания реакции:

k — константа скорости реакции, A — фактор частоты для реакции, R — универсальная газовая постоянная, T — температура в кельвинах.
Катализ и катализаторы. Гомогенные и гетерогенные катализаторы. Влияние катализаторов на величину энергии активации и константу скорости реакции.
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами.
Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.Катализаторы имеют ряд общих характерных особенностей:
1. Катализатор не влияет на общую стехиометрию реакции, он принимаетхимическое участие в процессе, расходуется на одной стадии и регенерируется надругой.
2. Катализатор уменьшает энергию активации реакции, благодаря чемуувеличивается ее скорость Катализатор не влияет на константу равновесия, он только сокращаетвремя достижения равновесия, одинаково увеличивая скорость прямой и обратной
реакций
32.Понятие о механизме химических реакций. Простые и сложные реакции, применение закона действия масс к простым и сложным реакциям. Кинетический порядок и молекулярность реакций. Цепные реакции: зарождение, развитие, и обрыв цепи (на примере неразветвленной цепной реакции водорода и хлора
Под механизмом химической реакции понимают те промежуточные реакции, которые протекают при превращении исходных веществ в продукты реакции.Все химические реакции подразделяют на простые и сложные. Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена.Примером химической реакции соединения может служить нагревание порошков железа и серы, - при этом образуется сульфид железа: Fe+S=FeS. Примером реакции разложение меже служить химичесмкая реакция разложения мела (илиизвестняка под воздействием температуры): СаСО3=СаО+СО2.Если взаимодействуют простое вещество и сложное —то эта химическая реакция называется химической реакцией замещения: Например опустив стальной гвоздь в расвор медного купороса получаем железный капорос (здесь железо вытеснило медь из её соли) Fe+CuSO4= FeSO4+Cu.
Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к химическим реакциям обмена. Большое их число протекает в водных растворах. Прмеромхимичес койреакцииобмена может служить нейтрализация кислоты щёлочью: NaOH+HCl=NaCl+Н2О.Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко. Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
33.Химическое равновесие. Обратимые и необратимые химические реакции. Константа химического равновесия. Факторы, определяющие величину константы. Катализ и химическое равновесие. Сдвиг химического равновесия, принцип ЛеШателье
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причем скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А + В⇄ С + D.В состоянии равновесия скорости прямой и обратной реакции становятся равными.Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:3H2 + N2 ⇆ 2NH3
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложениевзрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.Конста́нтаравнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс).Принцип ЛеШателье — Брауна (1884 г.) — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление,концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.лияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
