
- •1. Основные положения мкт. Идеальный газ.
- •Основные определения (давление, плотность количество вещества, константы и размерность)
- •2) Число молекул в вещества;
- •3) Число молекул в вещества;
- •Количество вещества можно найти по формуле
- •2. Основное уравнение мкт, температура, среднеквадратичная скорость
- •Основное уравнение молекулярно–кинетической теории записывается так:
- •Основное уравнение молекулярно–кинетической теории записывается так:
- •Основное уравнение молекулярно–кинетической теории записывается так:
- •Температура снизилась с до . Как изменилась при этом среднеквадратичная скорость молекул?
- •1) Уменьшилась в 2 раза;
- •3. Уравнение Менделеева-Клапейрона, газовые законы
- •Уравнение Менделеева–Клапейрона имеет вид
- •Уравнение Менделеева–Клапейрона имеет вид
- •Уравнение изобары имеет вид
- •4. Сложные задачи на газовые законы
- •5.Основные определения статистики Максвелла
- •6. Знание формул для статистики Максвелла, среднеквадратичная скорость
- •7.Распределение Больцмана (не везде знание формулы)
- •1) ; 2) ; 3)Обе формулы верны.
- •8. Длина свободного пробега
- •9. Термодинамика. Определения. 1-е начало. Простые вопросы.
- •10.Первое начало термодинамики для изопроцессов. Сложные формулы. Задачи.
- •11.Теплоёмкость, адиабатный процесс
- •12. Тепловые машины
- •13. Второе начало термодинамики. Энтропия
- •3. Обе формулы верны.
- •3. Обе формулы верны.
10.Первое начало термодинамики для изопроцессов. Сложные формулы. Задачи.
Для изохорного процесса справедливо
1)
 ;
2)
;
2)
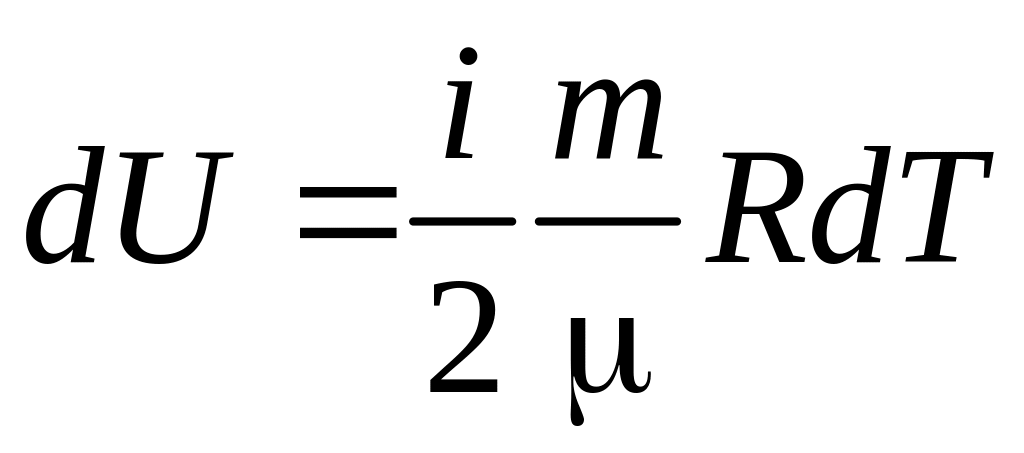 ; 3)
обе формулы справедливы.
; 3)
обе формулы справедливы.
Для изохорного процесса справедливо
1) ; 2) ; 3) обе формулы справедливы.
Для изохорного процесса справедливо
1)
;
2)
; 3)
![]() .
.
Для изотермического процесса работа равна
1)
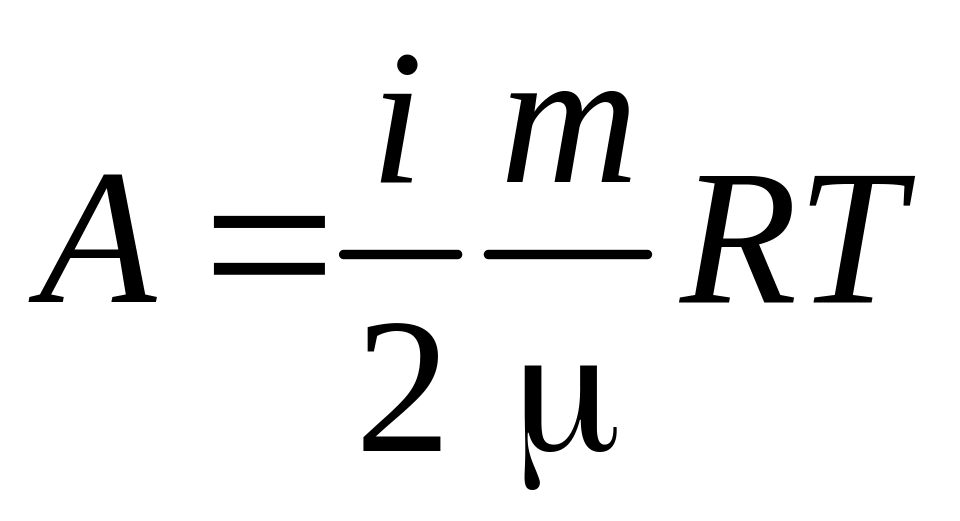 ;
2)
;
2)
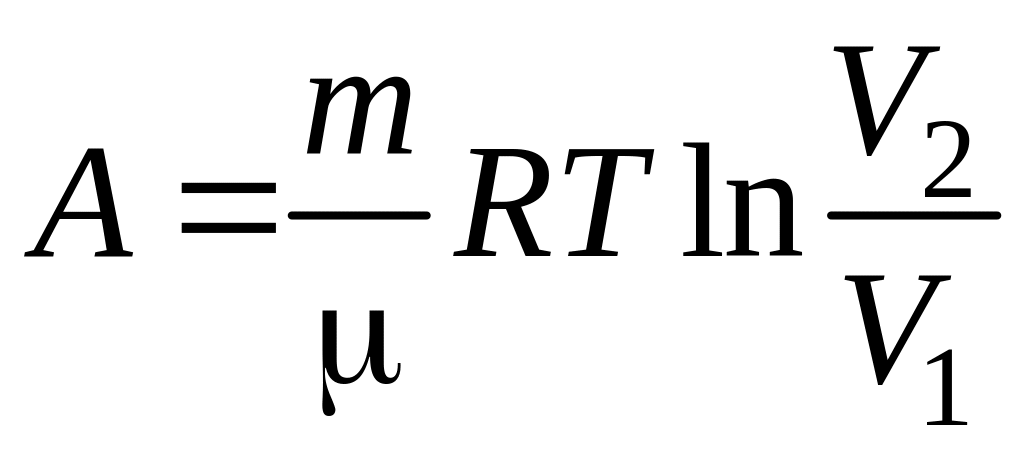 ; 3)
; 3)
 .
.
Работа при изотермическом процессе определяется по формуле
1)
 ; 2)
; 2)
 ; 3)
; 3)
 .
.
Для изотермического процесса справедливо
1)
 ;
2)
; 3)
обе формулы справедливы.
;
2)
; 3)
обе формулы справедливы.
Для изобарного процесса справедливо
1)
; 2)
; 3)
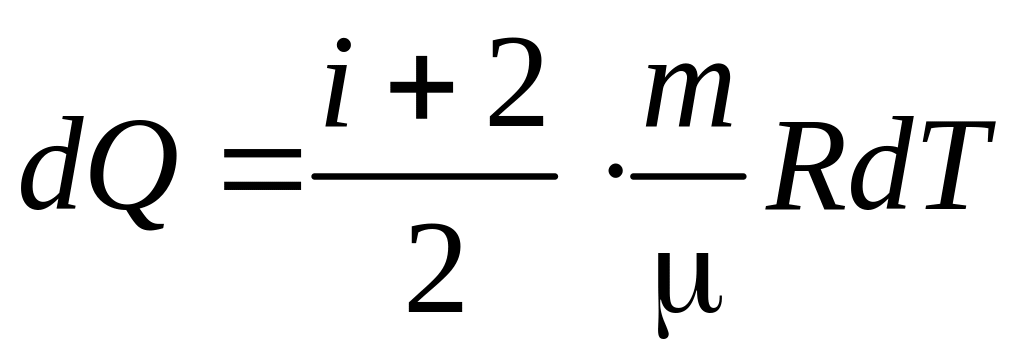 .
.
Один моль одноатомного газа при изохорном нагревании получил 500 Дж тепла. На сколько градусов изменилась его температура?
1) на 40 К; 2) на 50 К; 3) на 60 К.
Один моль одноатомного газа изохорно нагрели на 160 К. Какое количество тепла получил этот газ?
1) 1 кДж; 2) 2 кДж; 3) 3 кДж.
Один моль одноатомного газа при изобарном нагревании получил 600 Дж тепла. На сколько градусов изменилась его температура?
1) на 29 К; 2) на 39 К; 3) на 49 К.
Один моль одноатомного газа изобарно нагрели на 180 К. Какое количество тепла получил этот газ?
1) 1,74 кДж; 2) 2,74 кДж; 3) 3,74 кДж.
Один моль двухатомного газа при изохорном нагревании получил 700 Дж тепла. На сколько градусов изменилась его температура?
1) на 34 К; 2) на 46 К; 3) на 53 К.
Один моль трёхатомного газа при изобарном нагревании получил 800 Дж тепла. На сколько градусов изменилась его температура?
1) на 24 К; 2) на 34 К; 3) на 44 К.
Один моль двухатомного газа изохорно нагрели на 120 К. Какое количество тепла получил этот газ?
1) 2 кДж; 2) 2,6 кДж; 3) 2,9 кДж.
Один моль двухатомного газа при изобарном нагревании получил 800 Дж тепла. На сколько градусов изменилась его температура?
1) на 27,5 К; 2) на 31,5 К; 3) на 38,5 К.
Один моль двухатомного газа изобарно нагрели на 110 К. Какое количество тепла получил этот газ?
1) 2,7 кДж; 2) 3,2 кДж; 3) 3,6 кДж.
Один моль одноатомного газа при изобарном нагревании получил 400 Дж тепла. На сколько изменилась его внутренняя энергия?
1) на 200 Дж; 2) на 240 Дж; 3) на 280 Дж.
Один моль одноатомного газа при изобарном нагревании получил 700 Дж тепла. Какую работу он совершил?
1) 280 Дж; 2) 300 Дж; 3) 320 Дж.
Один моль двухатомного газа при изобарном нагревании получил 900 Дж тепла. На сколько изменилась его внутренняя энергия?
1) на 450 Дж; 2) на 600 Дж; 3) на 643 Дж.
Один моль двухатомного газа при изобарном нагревании получил 300 Дж тепла. Какую работу он совершил?
1) на 85 Дж; 2) 125 Дж; 3) 150 Дж.
11.Теплоёмкость, адиабатный процесс
Молярная теплоёмкость – это
1) количество теплоты, необходимое для нагревания 1 моля вещества;
2) количество теплоты, необходимое для нагревания 1 моля вещества на 1 К;
3) количество теплоты, необходимое для нагревания 1 моля вещества на 1 К за 1 с.
Количество теплоты, полученное системой при изохорном нагревании равно
1)
 ; 2)
; 2)
 ; 3)
; 3)
![]() .
.
Молярная теплоёмкость при изотермическом процессе
1) стремится к нулю;
2) стремится к бесконечности;
3) стремится к единице.
Молярная теплоёмкость измеряется в
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Молярная теплоёмкость газа при изохорном процессе равна
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Молярная теплоёмкость газа при изобарном процессе равна
1) ; 2) ; 3) .
Молярная теплоёмкость водорода при изобарном процессе равна
 :
:
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Молярная теплоёмкость водорода при изохорном процессе равна
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Молярная теплоёмкость гелия при изобарном процессе равна
1) ; 2) ; 3) .
Молярная теплоёмкость гелия при изохорном процессе равна
1)
![]() ; 2)
; 2)
![]() ; 3)
.
; 3)
.
Молярная теплоёмкость при постоянном давлении зависит от температуры газа согласно графику (в области обычных температур)
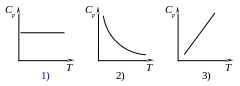
Молярная теплоёмкость при постоянном объёме зависит от температуры газа согласно графику (в области обычных температур)

Коэффициент Пуассона – это отношение
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Коэффициент Пуассона для гелия равен
1) 1,33; 2) 1,66; 3) 2.
Коэффициент Пуассона для водорода равен
1) 1,4; 2) 1,6; 3) 1,8.
При адиабатическом процессе изменяются:
1) давление, температура;
2) объём, температура;
3) давление, объём, температура.
При адиабатическом расширении газа
1) давление увеличивается, температура увеличивается;
2) давление уменьшается, температура увеличивается;
3) давление уменьшается, температура уменьшается;
Уравнение Пуассона записывается как
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Уравнение Пуассона записывается как
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Адиабатным процессом нельзя считать
1) очень быстрое сжатие газа;
2) очень медленное сжатие газа;
3) очень быстрое расширение газа.
При адиабатном расширении газа его температура
1) увеличивается;
2) уменьшается;
3) не меняется.
При адиабатном сжатии газа его температура
1) увеличивается;
2) уменьшается;
3) не меняется.
