
- •Оглавление
- •Особенности цепной структуры биополимеров
- •Структурная организация белков
- •Химические свойства белков
- •Физические свойства белков
- •Полусинтез пептидов и белков
- •Нуклеиновые кислоты
- •Структура нуклеиновых кислот
- •Структура и функции днк
- •Физико-химические свойства днк
- •Структура и функции рнк
- •Физико-химические свойства рнк
- •Химико-ферментативный синтез фрагментов днк
- •Биосинтез днк
- •1.Репликация днк
- •2.Транскрипция
- •Полисахариды
- •Синтез полисахаридов
- •Применение биополимеров
- •Литература
Полусинтез пептидов и белков
Полусинтез (частичный синтез) – способ получения соединений, заключающийся в комбинации природных пептидов и белков или их фрагментов с пептидами, полученными полным синтезом или модификацией природных объектов. Полусинтез можно рассматривать как методический прием, основанный на модификации природных соединений.
Полусинтез как способ получения соединений пептидно-белковой природы можно проиллюстрировать на примере инсулина. В 1972 г. впервые было осуществлено превращение инсулина свиньи в инсулин человека (М. Руттенберг). Молекулы этих гормонов отличаются лишь одним аминокислотным остатком: в положении В 30 в инсулине свиньи находится Ala (аланин), а в инсулине человека – Thr (треонин). Предложенная схема включала синтез гексаметилового эфира инсулина свиньи (обработкой диазометаном), расщепление В-цепи трипсином по остатку Arg-22, блокирование Вос-группой N-концевых остатков А- и В-цепей полученного «укороченного» инсулина, затем конденсацию продукта с синтетическим фрагментом В 23-30 инсулина человека и, наконец, удаление всех защитных групп. После интенсивной очистки удалось выделить инсулин человека с выходом около 10 %.
Позднее (1980 – 1983 гг.) были предложены еще два способа ферментативного превращения инсулина свиньи в инсулин человека (К. Морихара, Дж. Маркуссен). В 1983 г. разработан способ промышленного производства инсулина человека из инсулина свиньи, основанный на применении иммобилизованной протеиназы І из Achromobacter lyticus на стадиях гидролиза инсулина в дез-Ala В-30 инсулин и конденсации последнего с Thr-OBu (Т. Ока).

Рисунок 11. Полусинтез инсулина человека из инсулина свиньи.
Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования белков принесло Фредерику Сенгеру Нобелевскую премию по химии в 1958 г. Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракции рентгеновских лучей, соответственно, Максом Перуцем и Джоном Кендрю в конце 1950-х годов, за что в 1962 г. они получили Нобелевскую премию по химии.
Короткие белки могут быть синтезированы химическим путём с использованием методов органического синтеза, например, химического лигирования. Чаще всего химический синтез пептида происходит в направлении от C-конца к N-концу, в противоположность биосинтезу на рибосомах. Методом химического синтеза получают короткие иммунногенные пептиды (эпитопы), которые затем инъецируют животным с целью получения специфичных антител. Кроме того, этот способ также используется для получения ингибиторов некоторых ферментов. Химический синтез позволяет вводить в состав белков аминокислотные остатки, не встречающиеся в обычных белках, например, такие, к боковым цепям которых присоединены флюоресцентные метки.
Химические методы синтеза белков имеют ряд ограничений: они неэффективны при длине белка более 300 аминокислотных остатков, искусственно синтезированные белки могут иметь неправильную третичную структуру и у них отсутствую характерные посттрансляционные модификации
Для искусственного получения олиго- и полипептидов заданного строения применяются специальные приёмы пептидного синтеза: блокирование (защита) одних функциональных групп и активация других.
При синтезе полипептидов, содержащих большое число аминокислотных остатков, требуется проведение множества реакций, которые сопровождаются операциями по выделению и очистке продукта на каждой стадии. В классическом синтезе это сопряжено не только с большими затратами времени, но и с потерями вещества, поэтому при завершении эксперимента удается получить лишь ничтожно малые количества конечного продукта.
Для решения этих проблем был предложен твердофазный синтез пептидов на полимерной матрице (Р. Мэррифилд, 1962 г.). В настоящее время созданы автоматизированные приборы (синтезаторы), которые в запрограммированной последовательности осуществляют все необходимые операции. Если в классическом синтезе для присоединения одной аминокислоты требуются дни и даже недели, то условия твердофазного синтеза позволяют присоединить 6 аминокислот в сутки.
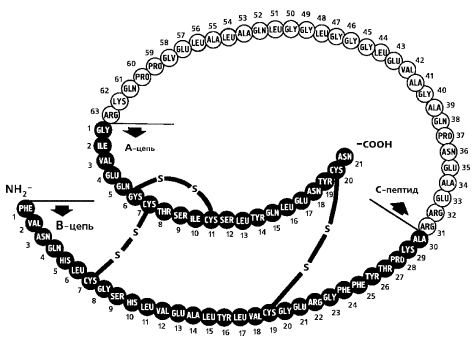
Рисунок 12. Инсулин человека.
Синтез инсулина сыграл значительную роль в совершенствовании методологии синтетической пептидной химии (1963 – 1965 гг.).
Следующей вехой в развитии синтетических исследований бил синтез S-белка рибонуклеазы А, предпринятый в США под руководством Р. Хиршмана (1963 – 1969 гг.). Стратегия синтеза отличалась от применявшихся ранее подходов тем, что авторы стремились использовать минимальное число защитных группировок и упростить стадии конечного деблокирования. В ходе синтеза был предложен способ удлинения пептидной цепи N-карбоксиангидридами аминокислот и введена в практику ацетамидометильная группа для SH-функции. В итоге Р. Хиршман и сотрудники получили продукт, обладающий в присутствии S-пептида 30 % активности рибонуклеазы А и рядом ее физико-химических показателей.
Среди классических синтезов простейших белков необходимо отметить синтез рибонуклеазы А, состоящей из 124 аминокислотных остатков (Х. Яджима, 1980) и синтез нейротоксина II (61 остаток) из яда среднеазиатской кобры (В.Т. Иванов и сотр., 1982). Синтез рибонуклеазы А (Б. Гутте, Р. Меррифилд, 1969 – 1971 гг.) и β-липотропина, содержащего 91 аминокислотный-остаток (Ч. Ли, Д. Ямаширо, 1978 г.), был осуществлен твердофазным методом.
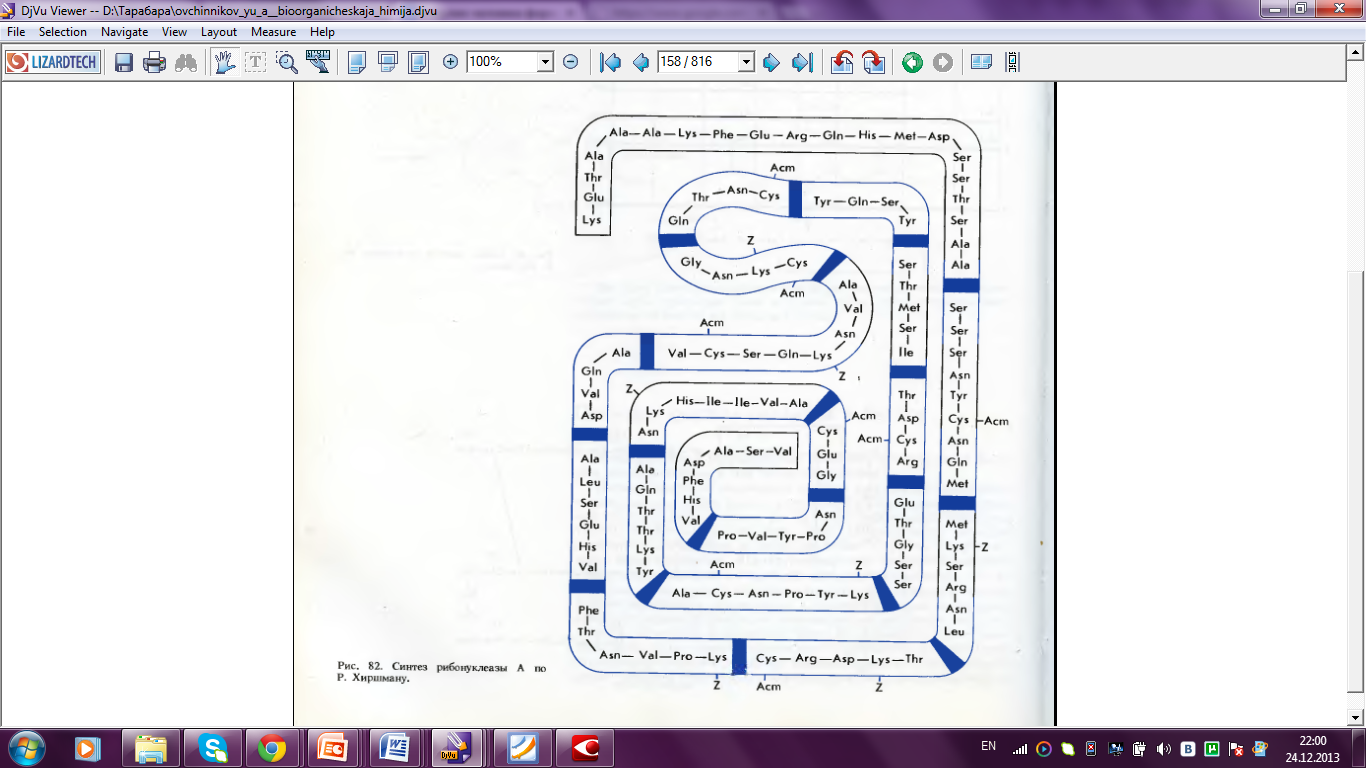
Рисунок 12. Синтез рибонуклеазы А по Р. Хиршману.
