
- •Оглавление
- •Особенности цепной структуры биополимеров
- •Структурная организация белков
- •Химические свойства белков
- •Физические свойства белков
- •Полусинтез пептидов и белков
- •Нуклеиновые кислоты
- •Структура нуклеиновых кислот
- •Структура и функции днк
- •Физико-химические свойства днк
- •Структура и функции рнк
- •Физико-химические свойства рнк
- •Химико-ферментативный синтез фрагментов днк
- •Биосинтез днк
- •1.Репликация днк
- •2.Транскрипция
- •Полисахариды
- •Синтез полисахаридов
- •Применение биополимеров
- •Литература
Оглавление
Y
Особенности цепной структуры биополимеров 4
Белки 6
Структурная организация белков 8
Химические свойства белков 11
Физические свойства белков 12
Полусинтез пептидов и белков 15
Нуклеиновые кислоты 18
Структура нуклеиновых кислот 19
Структура и функции ДНК 20
Физико-химические свойства ДНК 23
Структура и функции РНК 24
Физико-химические свойства РНК 25
Химико-ферментативный синтез фрагментов ДНК 25
27
Рисунок 19. Химический синтез олигонуклеотида. После n циклов образуется одноцепочечный фрагмент ДНК из n+1 нуклеотида. 27
Биосинтез ДНК 27
1.Репликация ДНК 27
2.Транскрипция 29
Полисахариды 31
Синтез полисахаридов 34
Применение биополимеров 37
Применение биополимеров при базальной имплантации. Самое революционное открытие в имплантации зубов за последние годы – биополимер PEEK, который по своим свойствам в несколько раз превзошел предшественника – титан. Импланты из биополимера PEEK впервые были разработаны во Франции под руководством доктора Франка-Петера Шпана и доктора Жана-Поля Донсимони. В 2005 году на Европейский рынок вышли биополимерные имплантаты на базе биополимера PEEK-Optima. Благодаря своим качествам, биополимер PEEK-Optima может служить для долгосрочной имплантации. Этот материал, в отличие от титана, обладает композитной неоднородностью, что позволяет добиться более полного соответствия анатомическим особенностям пациента. Биополимер биологически совместим, с ним не возникает вопросов о воспалениях, он гипоаллергенный. Помимо этого, биополимер обладает такими качествами как, упругость, твердость, устойчивость к химическому воздействию. 38
Литература 39
Биополимеры – это класс полимеров, встречающихся в природе в естественном виде и входящие в состав живых организмов.
К биополимерам относятся белки, нуклеиновые кислоты, полисахариды, лигнин.
Биополимеры состоят из одинаковых (или разных) звеньев – мономеров. Мономеры белков – аминокислоты, нуклеиновых кислот – нуклеотиды, в полисахаридах – моносахариды.
Выделяют два типа биополимеров – регулярные (некоторые полисахариды) и нерегулярные (белки, нуклеиновые кислоты, некоторые полисахариды).
Особенности цепной структуры биополимеров
Биополимеры обладают рядом особенностей:
состоят из большого числа атомов;
имеют большое число функциональных групп;
значительное число степеней свободы.
Биополимеры имеют цепное строение, причем большинство из них имеют линейную структуру. Количество разветвленных биополимеров не так велико, в качестве примера можно привести молекулу гликогена. Цепи биополимеров могут быть построены из одинаковых мономеров (гомополимеры) или разных (гетерополимеры/сополимеры). Биополимеры ограничены в своем вращении дальними связями (дальние взаимодействия), которые реализуются в результате свертывания.
Подвижность полимеров может иметь статистический и детерминированный (механический) характер. Статистическая подвижность биополимера – это варианты отдельных элементов структуры, повороты вокруг одинарных связей. Форма и размеры молекулы зависят от статистической подвижности биополимера. Детерминированный характер движения обуславливает функциональные изменения в молекуле. Оба типа движений свойственны всем биополимерам и могут идти одновременно.
Сворачивание биополимера в пространстве приводит к образованию клубка или глобулы.
Глобула – вид пространственной структуры полимера, с компактной пространственной структурой, с малыми флуктуациями плотности, с однородной сердцевидной и постоянной концентрацией звеньев.
Клубок – вид пространственной структуры полимера, при котором взаимодействуют только соседние звенья, с большим количеством конформаций и отсутствует внутренняя структура (рис. 1).

Рисунок 1. Строение клубка и глобулы.
С увеличением температуры происходит увеличение сил отталкивания и уменьшение сил притяжения. Все взаимодействия между атомами независимо от их конкретной физической природы при формировании различных макромолекулярных структур и переходов между ними можно разделить на два типа: взаимодействия ближнего порядка между атомами соседних звеньев и дальние взаимодействия или объемные эффекты между атомами, которые хотя и отстоят по цепи далеко друг от друга, но случайно сблизились в пространстве в результате изгибания цепи.
В стабилизации молекулы биополимера принимают участие следующие объемные взаимодействия:
водородные связи;
электростатические силы;
Ван-дер-Ваальсовы взаимодействия;
гидрофобные взаимодействия.
Возникновение водородной связи можно объяснить действием электростатических сил. Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки (рис. 2 а), нуклеиновые кислоты (рис. 2 б) и полисахариды (рис. 2 в).
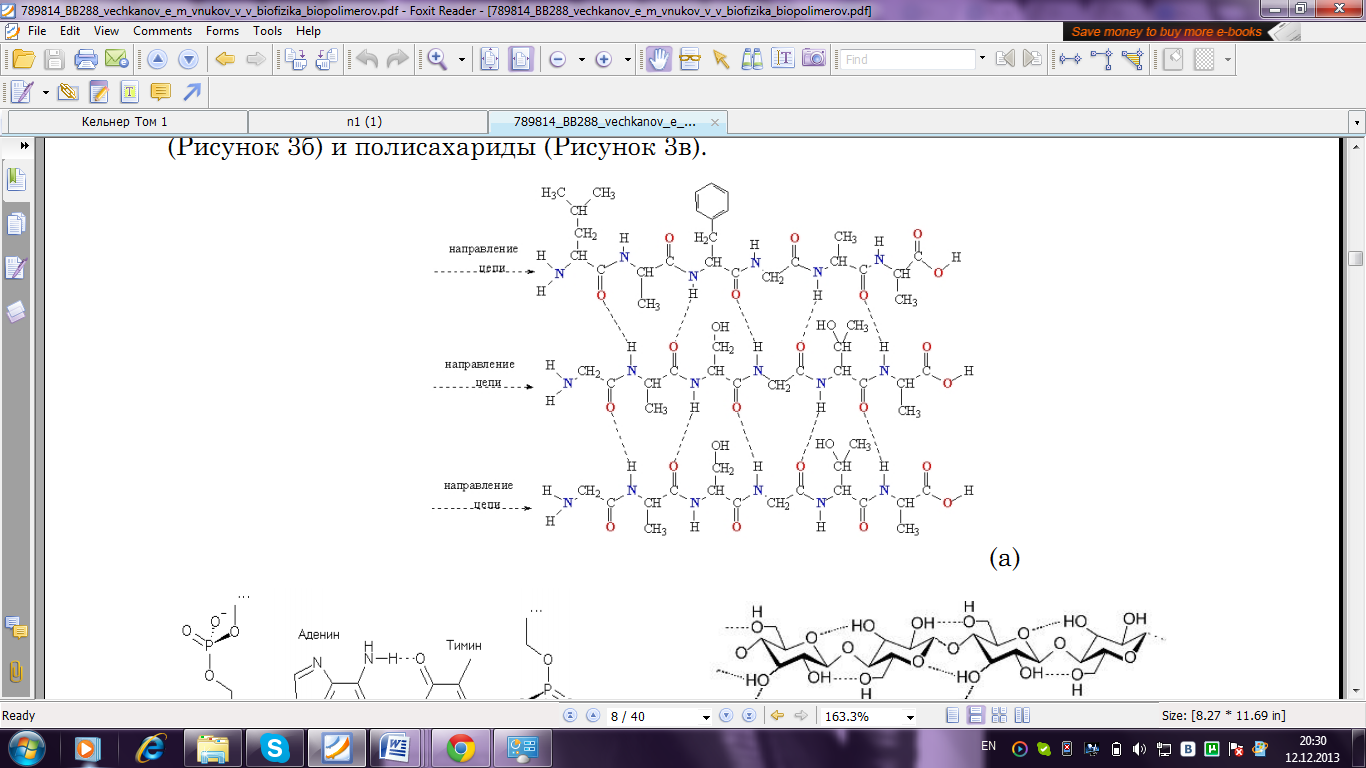

Рисунок 2. Водородная связь между молекулами белка (а), азотистыми основаниями ДНК (б) и целлюлозы (в).
Связь этого типа слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях.
Электростатические взаимодействия образуются за счет взаимодействия электростатически-заряженных групп в молекуле биополимера. В молекулах белков роль электростатически-заряженных центров играют положительно (аргинин, лизин, гистидин) и отрицательно заряженные (глутаминовая и аспарагиновая кислота) радикалы аминокислот. В молекуле ДНК электростатически-заряженны остатки фосфорной кислоты. В растворе биополимеры ведут себя как типичные полиамфолиты. В молекулах нуклеиновых кислот преобладает отрицательный заряд, заряд белка зависит от ионной силы раствора и от рН среды.
Силы Ван-дер-Ваальса имеют электромагнитную природу и связаны с взаимодействием электрических диполей в соседних молекулах. В зависимости от того, обладают ли взаимодействующие молекулы постоянными электрическими дипольными моментами или последние возникают вследствие поляризуемости электронных оболочек, существуют различные типы сил Ван-дер-Ваальса:
дисперсионные взаимодействия;
ориентационные взаимодействия;
индукционные взаимодействия.
Белки
Белки – это природные высокомолекулярные азотсодержащие полимеры, построенные из остатков α-аминокислот, составляющие основу живых структур.
Впервые белок (клейковина) был выделен Я. Беккари из пшеничной муки в 1728 г. К настоящему времени из природных источников выделены и изучены сотни различных белков.
Любая живая клетка, ткань, орган в животном или человеке – это сложная система, состоящая из очень большого количества различных белков. Например, белок плазмы крови состоит минимум из восьми различных белков; белок куриного яйца представляет собой систему из десяти индивидуальных белков. В самой маленькой и просто устроенной бактериальной клетке обнаружено более 2000 различных белков.
Среди ученых многих стран, внесших большой вклад в изучение белков, следует отметить Э. Фишера, Т. Курциуса, М. Бергмана, Ф. Сенгера, П. Эдмана, А.Я. Данилевского, Н.Д. Зелинского, В.С. Садикова, Д.Л. Талмура и др.
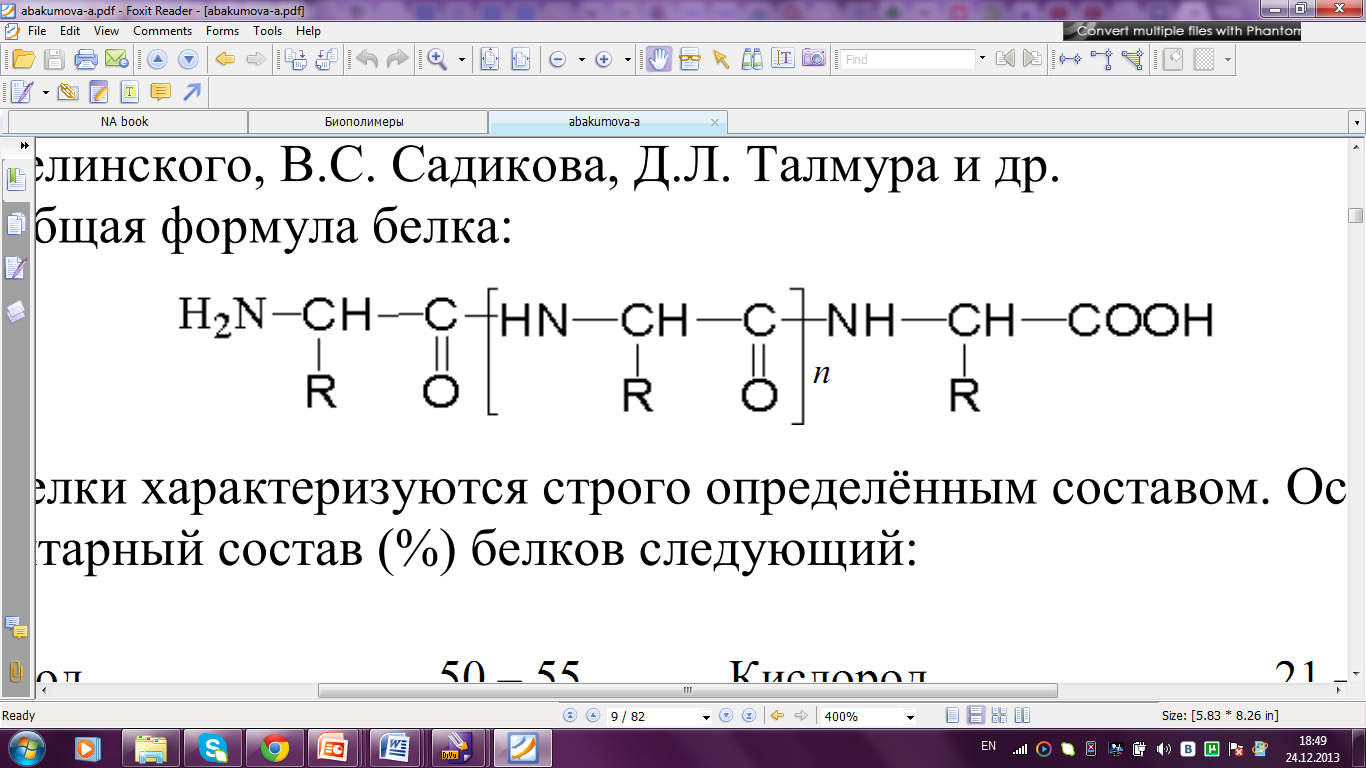
Рисунок 3. Общая формула белка.
Белки характеризуются строго определенным составом. Основной элементарный состав (%) белков:
углерод – 50-55
водород – 6,5-7,3
азот – 15-18
кислород – 21-24
сера – 0-2,4
фосфор – 0,1-2,1.
В небольших количествах в белках присутствуют железо, йод, медь, цинк, бром, марганец, кальций, кобальт, магний и другие элементы.
Классификация белков
1.По строению:
простые, или протеины – белки, дающие при гидролизе только аминокислоты;
сложные белки состоят из протеина и добавочной группы небелковой природы (простетической группы):
фосфоропротеиды – простетическая группа – фосфорная кислота. Это казеин молока, ихтулин.
глюкопротеиды (мукопротеиды) – простетическая группа представлена углеводами, чаще всего мукополисахаридами. Это муцин, мукоиды.
липопротеиды – простетическая группа представлена жирами или жироподобными веществами.
хромопротеиды – простетическая группа представлена окрашенными веществами. Это гемоглобин, миоглобин, хлорофилл, гемоцианин.
Гемоглобин – красящее вещество крови, важной функцией которого является перенос кислорода от лёгких к тканям.

Рисунок 4. Структурная формула гемоглобина.
Хлорофилл – магнийсодержащий хромопротеид, состоит из пиррольных колец, соединенных магнием.

Рисунок 5. Структурная формула хлорофилла.
нуклеопротеиды – простетическая группа – нуклеиновые кислоты. Участвуют в синтезе белка и передаче наследственной информации. Белковая часть представлена гистонами и протаминами.
2.По форме частиц:
фибриллярные (волокнистые);
глобулярные (корпускулярные).
3.По растворимости:
Белки – это полимеры с гидрофильными свойствами. Степень растворимости белков в различных растворителях определяет в значительной степени характер радикалов аминокислот: полярный или неполярный (аланин, валин, лейцин, фенилаланин, триптофан и т. д.).
протеиноиды – белки, нерастворяющиеся в обычных растворителях белков: воде, солевых и водно-спирнтовых смесях. Примеры: коллаген, остеин, кератином.
альбумины – белки, хорошо растворяющиеся в воде и крепких солевых растворителях. Входят в состав крови человека (до 50 %), широко распространены в природе.
глобулины – нерастворимы в воде и солевых растворах умеренных концентраций.
проламины – группа белков, растворимых в 60–80 % водном растворе этилового спирта, в щелочи.
глютемины – растворимы в кислотах и щелочах.
гистоны и протамины – растворимы в щелочах.
4.По выполняемым функциям:
структурные (коллаген, фиброин, кератин…);
двигательные (актин, миозин);
каталитические (энзимы);
транспортные (гемоглобин, миоглобин, цитохром…);
регуляторные (гормоны – гистоны);
защитные (антитела и иммуноглобулины);
рецепторные (родопсин, холинорецептор…);
запасные и питательные (казеин молока, яичный альбумин…);
токсичные (токсины ботулинический, дифтерийный);
антибиотики (актиноксантин, неокарциностатин…).
