
- •1.Получение порошков. Классификация методов. Механические методы. Назначение, состав, принцип действия и параметры щековой дробилки
- •2.Получение порошков. Назначение, состав, принцип действия, оптимальные режимы и параметры барабанной мельницы
- •3 Диспергирование расплавов газом
- •4.Получение порошков центробежным диспергированием расплавов. Разновидности метода. Основные параметры.
- •5.Химические методы получения порошков. Метод восстановления. Основы теории. Получение порошка вольфрама.
- •6.Физико-химические методы получения порошков. Плазмо-химический метод. Схема установки. Получение порошка никеля
- •7. Карбонил процесс.
- •8.Свойства порошков. Классификация свойств. Химические и физические свойства: методика определения, единицы измерения.
- •9.Технологические свойства порошков: определение, методика определения, единицы измерения.
- •9.Технологические свойства порошков: определение, методика определения, единицы измерения.
- •10.Формование порошков. Классификация методов формования. Основы теории. Подготовка формовочных масс: сухие, полусухие, пластичные, жидкотекучие формовочные массы.
- •11.Холодное прессование в жестких формах. Схемы. Пресс-инструмент. Технологические параметры.
- •12.Горячее прессование. Схема установки. Технологический регламент.
- •13.Изостатическое прессование. Классификация. Холодное гидростатическое прессование. Принципиальная схема гидростата. Схема эпф. Технологическая схема хип
- •14.Горячее газостатическое прессование. Принципиальная схема газостата. Технологическая схема гип. Технологические параметры.
5.Химические методы получения порошков. Метод восстановления. Основы теории. Получение порошка вольфрама.
При получении порошков хим. методами происходят глубокие хим. превращения.
Получение порошков восстановлением соединений.
Металлические порошки получают в рез-те восстановления оксидов галагенидов и других соединений веществами восстановителями: газами (водород, СО и др.), твёрдыми веществами (углерод), металлами (Mg, Ca, Na, Al).
Основы теории.
Реакция восстановления записывается след. образом:
МеА+Х=Ме+ХА, где Ме-восстанавливаемый металл; А-неметаллическая составля- ющая соединения (O2, F, Cl и др.); Х-восстановитель (газ, тв. вещ-во, металл).
Термодинамический анализ состоит в определении условий протекания процесса восстановления в требуемом направлении. Восстановителем может быть вещ-во, которое в условиях реакции (t, концентрация, давление) обладает большим химическим сродством к неметаллической составляющей А, чем восстанавливаемый металл. Хим. сродство – это прочность хим. связи. Мерой хим. сродства служит величина свободной энергии освобож- дающейся при образовании хим. соединения, чем больше высвобождается энергии, тем прочнее хим. соединение. Поэтому реакция восстановления возможна лишь в случае, если при образовании нового соединения с восстановителем выделяется энергии больше, чем при образовании соединения металла с тем же элементом А.
Zr+O2=ZrO2-420 кдж/моль
2Са+О2=2СаО+525 кдж/моль
Средний тепл. коэф-т показывает, что Са может использоваться в качестве восстановителя ZrO2.
Восстановление газом.
Механизм восстановления соединений металлов с газами основывается на адсорб- ционно-автокаталитической теории. Эта теория предусматривает следующую последова- тельность элементарных актов гетерогенной топохимической реакции.
![]()
![]()
![]()
![]()
1. Адсорбция газа восстановителя на поверхности восстанавливаемого соед-я.
2. Отдача электронов восстановителя в решётку соединения.
3) Отрыв ионов неметаллической составляющей А и соединение их с атомами вос- становителя.
4) Десорбция образующихся молекул нового соединения ХА.
5) Соединение ионов восстанавливаемого металла с электронами восстановителя и рост кристаллов.
По мере протекания реакции реагирующая поверхность, а значит и скорость реак- ции увеличивается в рез-те её искривления относительно кристаллов образовавшегося ме- талла. Ускорение реакции заканчивается после выравнивания реагирующей поверхности. В дальнейшем реакционная поверхность имеющая форму сферы уменьшается, а значит и уменьшается скорость процесса.
Основы кинетики.
Кинетика определяет скорость протекания процессов восстановления, т.е. кол-во вещества прореагировавшего в единицу времени. Важное влияние на кинетику процесса оказывают:
1) Удельная поверхность исходных веществ (дисперсность шихты).
2) Хар-ки адсорбции.
3) Хар-ки хим. взаимодействия в адсорбированных слоях.
4) Присутствие катализатора.
5) Хар-ки десорбции газообразных продуктов реакции.
6) Хар-ка диффузионных процессов.
Восстановление W ангидрида водородом.
WO3+3H2=W+3H2O
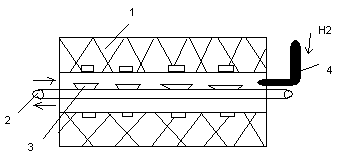
Дробление ангидрида→Рассев→Дозирование→Восстановление (Н2)→Разгрузка→ Измельчение→Сипар.
1-Трубчатая печь с зональным нагревом в диапазоне 700-1200°С; 2-Конвейер; 3-Лодочки (поддоны) с порошком W ангидрида; 4-Устройство подачи водорода в печь.
Схема печи восстановления: технологические параметры - t, производительность подачи водорода, скорость движения лодочки, высота слоя исходного материала. Содержа- ние влаги в водороде оказывает существенное влияние на размер частиц W. Как правило размер частиц составляет 10-15 мкм.
