
- •&2. Классификация неорганических веществ. Номенклатура
- •2.1 Генетическая связь
- •2.2 Номенклатура
- •3.1 Строение атома
- •3.2. Квантовые числа. Движение электрона в атоме. Атомная орбиталь
- •&4. Периодическая система химических элементов
- •5.1 Общие положения.
- •5.2 Метод валентных связей
- •5.3. Метод молекулярных орбиталей
- •6. Общие понятия и методы подбора коэффициентов в окислительно-восстановительных реакциях
- •7.1 Первый закон термодинамики
- •7.2 Основные понятия
- •Электролиз анионов
- •Электролиз расплавов
6. Общие понятия и методы подбора коэффициентов в окислительно-восстановительных реакциях
Окисли́тельно-восстанови́тельные реа́кции, также редокс (англ. redox, от reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Степенью окисления называют условный электрический заряд, который получил бы данный атом, если каждая общая пара электронов, связывающая его с другим атомом, полностью перешла бы к более электроотрицательному атому. Это тот условный заряд атома, который вычисляют, исходя из предположения, что молекула или молекулярный ион состоят только из одноатомных ионов
Для определения степени окисления атома в химическом соединении используют следующие условные допущения:
– водород во всех соединениях (кроме гидридов металлов) имеет степень окисления +1;
– кислород во всех соединениях (кроме пероксосоединений) имеет степень окисления −2;
– степень окисления атомов в простых веществах равна нулю
Степени окисления и характерные степени окисления химических элементов представлены на рисунке.


Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановителями называются вещества, атомы или ионы которых отдают электроны. Очевидно, что только восстановительными свойствами обладают вещества, которые содержат в своем составе атомы, находящиеся в низшей степени окисления (они способны только повышать свою степень окисления). Восстановительными свойствами могут обладать и вещества, содержащие атомы в промежуточной степени окисления, или простые вещества – металлы и неметаллы. К типичным и часто используемым в практике восстановителям относятся многие металлы в виде простых веществ (Na, K, Ca, Mg, Al, Zn), такие неметаллы, как углерод, бор, кремний, водород в виде простых веществ, а также сероводород, иодоводородная кислота и ее соли, соли олова (II) и железа (II) и некоторые другие.
Восстановлением называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислителями называются вещества, атомы или ионы которых принимают электроны. Очевидно, что только окислительными свойствами обладают вещества, которые содержат в своем составе атомы, находящиеся в высшей степени окисления (они способны только понижать свою степень окисления).
Окислительными свойствами могут обладать и вещества, содержащие атомы в промежуточной степени окисления, или простые вещества – неметаллы. Так, к типичным и часто используемым в практике окислителям относятся кислород и галогены в виде простых веществ, азотная кислота, царская водка, концентрированная серная кислота, дихромат калия, хлорат калия (бертолетова соль ), перманганат калия, перокосодисульфат аммония и некоторые другие
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
Способы уравнивания окислительно-восстановительных реакций
Подбор стехиометрических коэффициентов в ОВР можно проводить различными методами. Рассмотрим подробно метод электронного баланса на примере реакции: Ca3(PO4)2 + C + SiO2 Þ CaSiO3 + P + CO
Порядок нахождения коэффициентов следующий:
а) Определяем элементы, меняющие степень окисления – это P и C.
б) Составляем электронные уравнения процессов восстановления и окисления, учитывая количество атомов восстановителя или окислителя в исходных молекулах:
2P+5 + 10ē → 2P0, процесс восстановления, P+5 – окислитель.
C0 - 2ē → C+2 , процесс окисления, C0 – восстановитель.
в) Находим наименьшее общее кратное, чтобы уравнять количество электронов в процессах окисления и восстановления:
2P+5 + 10ē → 2P0
C0 - 2ē → C+2
г) Подставим найденные из электронного баланса коэффициенты в уравнение ОВР: Ca3(PO4)2 + 5C + SiO2 Þ CaSiO3 + 2P + 5CO
д) Подбор следующих коэффициентов осуществляем в строгой последовательности:
уравниваем катионы, не меняющие степень окисления (в данном случае – Ca+2);
уравниваем неметаллы, не меняющие степень окисления (Si+4);
уравниваем атомы водорода (в данном случае они отсутствуют).
Ca3(PO4)2 + 5C + 3SiO2 Þ 3CaSiO3 + 2P + 5CO
е) правильность подбора коэффициентов проверяем просчитывая число атомов кислорода в правой и левой части уравнения. Если число атомов кислорода в правой и левой частях не совпадает, то необходимо начинать проверку с самого начала – с определения степени окисления.
В некоторых реакциях кислоты, выступающие как окислитель (или восстановитель), могут выполнять и роль среды, выступая в качестве солеобразователя без изменения степени окисления:
Cu + HNO3(конц.) → Сu(NO3)2 + NO2 + H2O
 Cu0
- 2ē → Cu+2
2 1 Cu0
– восстановитель, окисление
Cu0
- 2ē → Cu+2
2 1 Cu0
– восстановитель, окисление
N+5 + ē → N+4 1 2 2 N+5 – окислитель, восстановление
Cu + 2HNO3(окислитель) + 2HNO3(солеобразователь) → Сu(NO3)2 + 2NO2 + 2H2O
Итоговое: Cu + 4HNO3 → Сu(NO3)2 + 2NO2 + 2H2O.
.
Для иллюстрации использования метода полуреакций для уравнивания ОВР рассмотрим также последнюю реакцию:
KMnO4 + HCl → MnCl2 + KCl + Cl2 + H2O
(Mn+7O4)- + 5ē + 8H+ → Mn+2 + 4H2O
2Cl- - 2ē → Cl2
Число протонов H+ определяется тем, сколько молекул H2O должно образоваться в правой части уравнения из четырех атомов кислорода, входящих в состав молекулы KMnO4. Затем уравниваем число отданных и принятых электронов и подставляем, полученные коэффициенты в ОВР:
2(Mn+7O4)- + 16H+ + 10Cl- → 2Mn+2 + 8H2O + 5 Cl2
И, наконец: 2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
Рассмотрим еще пример: KClO3 + HCl Þ KCl + Cl2 + H2O

 Cl+5O3-
+ 6H+
+ 6ē Þ
Cl-
+ 3H2O
1
Cl+5O3-
+ 6H+
+ 6ē Þ
Cl-
+ 3H2O
1
2Cl- - 2ē Þ Cl2 3
ClO3- + 6H+ + 6Cl- Þ Cl- + 3H2O + 3Cl2
KClO3 + 6HCl Þ KCl + 3H2O + 3Cl2
Правила:
Кислая среда
1. В кислой среде для связывания кислорода в кислородсодержащем ионе (молекуле) в полуреакциях используется протоны. Количество протонов должно быть в два раза больше атомов кислорода, которые связываются. При этом образуется вода, число которой равно количеству связанного кислорода – реакция восстановления.
ЭлОxy- +2yH+ → Элz+ + yH2O или ЭлОxy- +2aH+→ ЭлO(x-a) z+ + aH2O
Например:
MnO4-+ 5ē + 8H+ → Mn+2 + 4H2O и NO3-+ 3ē + 4H+ →NO + 2H2O
2. В кислой среде при образовании кислородсодержащего иона (молекулы) из некислородсодержащего иона или молекулы используется вода. Одна молекула воды прибавляет один атом кислорода, при этом образуется 2 протона – реакция окисления.
Элz+ + xH2O → ЭлОxy- +2xH+
Например:
S2- + 4H2O → SO42- + 8H+ или H3PO3 + H2O→ H3PO4 + 2H+
Щелочная среда
1. В щелочной среде для связывания кислорода в кислородсодержащем ионе (молекуле) в полуреакциях используется вода. Количество воды должно быть столько же, сколько атомов кислорода, которые связываются. При этом образуется гидроксид-ионы, число которых в 2 раза больше, чем связанного кислорода – реакция восстановления.
MnO4- +2 H2O → MnO2 + 4OH-
2. В щелочной среде при образовании кислородсодержащего иона (молекулы) из некислородсодержащего иона или молекулы используется гидроксид-ионы. При этом образуется вода, число которой в два раза меньше чем гидроксид – ионов
Например:
B4O72- + 10OH- → 4 BO3- + 5H2O
Расчет стандартного электродного потенциала. Уравнение Нернста
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:
Aox + n·e− → Ared,
то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар
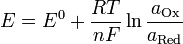
Если реакция идет при нормальных условиях, то

&7 Основы термодинамики
Химическая термодинамика — раздел физической химии, изучающий процессы взаимодействия веществ методами термодинамики.
Основными направлениями химической термодинамики являются:
Классическая химическая термодинамика, изучающая термодинамическое равновесие вообще.
Термохимия, изучающая тепловые эффекты, сопровождающие химические реакции.
Теория растворов, моделирующую термодинамические свойства вещества исходя из представлений о молекулярном строении и данных о межмолекулярном взаимодействии.
