
- •&2. Классификация неорганических веществ. Номенклатура
- •2.1 Генетическая связь
- •2.2 Номенклатура
- •3.1 Строение атома
- •3.2. Квантовые числа. Движение электрона в атоме. Атомная орбиталь
- •&4. Периодическая система химических элементов
- •5.1 Общие положения.
- •5.2 Метод валентных связей
- •5.3. Метод молекулярных орбиталей
- •6. Общие понятия и методы подбора коэффициентов в окислительно-восстановительных реакциях
- •7.1 Первый закон термодинамики
- •7.2 Основные понятия
- •Электролиз анионов
- •Электролиз расплавов
3.2. Квантовые числа. Движение электрона в атоме. Атомная орбиталь
Представления о строении атома прошли сложный путь развития. Очень важную роль в развитии теории строения атома сыграла планетарная модель атома Резерфорда. Однако эта модель не смогла объяснить движение электронов в атоме. Современная модель атома базируется на представлениях о микромире - мир частиц микроскопических размеров, которые не поддаются законам макромира. Электрон, как микрочастица, имеет определенную массу и заряд. В то же время электрон, двигаясь с огромной скоростью, проявляет волновые свойства. Говорят, что электрон имеет двойственную природу - одновременно проявляет свойства и частицы и волны. Благодаря этому для электрона невозможно одновременно определить скорость движения и направление.
Уравнение Шредингера – уравнение, описывающее изменение в пространстве и во времени чистого состояния электрона, задаваемое волновой функцией (волновая функция – вероятность обнаружения объекта (электрона) в одном из чистых состояний).
Пространство вблизи ядра, в котором вероятность нахождения электрона достаточно велика (примерно девяносто процентов), называется орбиталью. Это пространство ограничивается поверхностью, то есть объемной геометрической фигурой.
Атмана орбиталь – одноэлектронная волновая функция, полученная решением уравнения Шредингера.
Орбитали (электронные облака) отличаются не только размерами, так и формой.
Атомная орбиталь описывается 4 квантовыми числами.
- главное квантовое число – введено Бором – «n» - определяет энергетический уровень электрона на орбите. n принимает значение целых чисел от 1 до ∞. ∞ означает отрыв электрона от атома.
- орбитальное квантовое число – введено Зоммерфельдом - «l» - определяет форму атомной орбитали. l принимает значение от 0 до n-1/
Значение l |
0 |
1 |
2 |
3 |
обозначение |
s |
p |
d |
F |
 -
магнитное квантовое число – «m»-
определяет пространственное расположение
орбитали (см. выше) – опыт П.Зеемана в
1896 г, вводится уравнением Шредингера.
-
магнитное квантовое число – «m»-
определяет пространственное расположение
орбитали (см. выше) – опыт П.Зеемана в
1896 г, вводится уравнением Шредингера.
m принимает целые значения от – l (орбитальное квантовое число) до l (значения идут через «ноль»)
- спиновое квантовое число – «s» - введено Паули в 1924 – угловое вращение электрона
s = ±½
правила заполнения электронных орбиталей:
- принцип Паули (правило запрета) – два и более электрона не могут иметь все одинаковые квантовые числа (не могут находится в одинаковых квантовых состояниях).
- правило Хунда – модуль суммарного спинового числа должен быть максимальный
- правило Клечковского (правило n+l) – эмпирическое правило – при заполнении орбитальных оболочек атома более предпочтительны (а значит более энергетически выгодны – заполняются раньше) те состояния, для которых сумма главного квантового и орбитального чисел минимальна.
&4. Периодическая система химических элементов
Предшественники и продолжатели
1772 Л. Гитон де Морво составил первую таблицу «химически простых» веществ. А. Лавуазье использовал ее в своей книге «Начальный учебник химии», опубликованной в 17К9 г. 1817-1К29 И. Дёбернейнер открыл несколько триaд элементов и их соединений, в которых эквивалентный вес центрального элемента триады являлся средним из эквивалентных весов двух других элементов (например, СаО, SrO, ВаО илы NiО, СuО, ZnO).
1843 Л. Гмелин включил V-образнсе построение из 16 триад в 4-е издание своего «Справочника по химии».
1857 Ж. Дюма опубликовал таблицу 32 элементов из 8 колонок, показывающую взаимоотношения элементов.
1862 А. де Шанкуртуа впервые расположил элементы н порядке возрастания атомных весов; в публикации 1863 г. он придав этому ряду форму пространственной спирали, расположив сходные элементы друг под другом.
1864 Л. Мейер опубликовал таблицу валентностей для 49 элементов.
1864 У. Одлинг составил почти правили зую таблицу, в 17 вертикальных колонках которой были размещены 57 элементов.
1865 Дж. Ньюлендс после двух лет работы над различными вариантами классификации элементов предложил закон октав; он также правильно предсказал атомный вес еще неоткрытого элемента германия 1868-1869 Л. Мейер построив кривую атомных объемов и составил периодическую таблицу (таблица опубликована лишь в 1895 г.).
1869 Д.И. Менделеев сформулировал свой периодический закон: «свойства элементов находятся в периодической зависимости от их атомных весов» и опубликовал несколько вариантов периодической таблицы, один из них содержал 63 элемента.
1871 Д.И. Менделеев усовершенствовал свою таблицу и предсказал открытие 10 элементов (ныне они известны как Sс, Gа, Ge, Тc, Rе, Ро, Fг, Ra, Аc, и Ра). С поразительным предвидением он полностью описал свойства четырех из них (Sс, Gа, Ge и Ро). Заметим, однако, что в то время было невозможно предсказать существование благородных газов или число лантанидов.
1894-1898 Лорд Рэлей, У. Рамзай и М. Траверс открыли и затем выделили благородные газы (Не), Ne, Аr, Кr, Хе.
1913 Н. Бор объяснил форму периодической таблицы на основе своей теории строения атома и показал, что возможно существование лишь 14лантаноидов.
1913 Г. Мозли обнаружил закономерности в характеристических рентгеновских спектрах элементов, установил смысл атомного (порядкового) номера элемента Z и подтвердил правильность расположения элементов в периодической таблице (закон Мозли).
1940 Э. Макмиллан и Ф. Эйблсон синтезировали первый трансурановый элемент 93Np. Другие трансурановые элементы были синтезированы Г. Сиборгом с сотрудниками в течение следующих 15 лет.
1944 Г. Сиборг выдвинул актинидную гипотезу и предсказал существование в этой группе 14 элементов (вплоть до Z= 103).
Периодический закон открыт Д.И.Менделеевым в 1869 году.
Современная формулировка периодического закона:
Периодическое изменение свойств элементов и их соединений зависит от периодически повторяющейся подобной структуры электронной оболочки их атомов.
Наглядным выражением периодического закона является периодическая система элементов.
В периодической системе каждый элемент имеет свой порядковый номер, смысл которого теперь совершенно ясен: этот номер равен заряду ядра атома и числу электронов в оболочке атома.
Современный вариант периодической системы утвержден Международным союзом по теоретической (чистой) и прикладной химии – ИЮПАК – в 1989 году.
Система элементов слагается из периодов (горизонтальные строки) и групп (вертикальные столбцы).
Периодов в системе семь: 1 – 3 –малые, остальные – большие, седьмой – не завершен. Номер периода указывает на число уровней в атоме данного элемента.
Групп в системе - 18, они обозначаются арабскими цифрами.
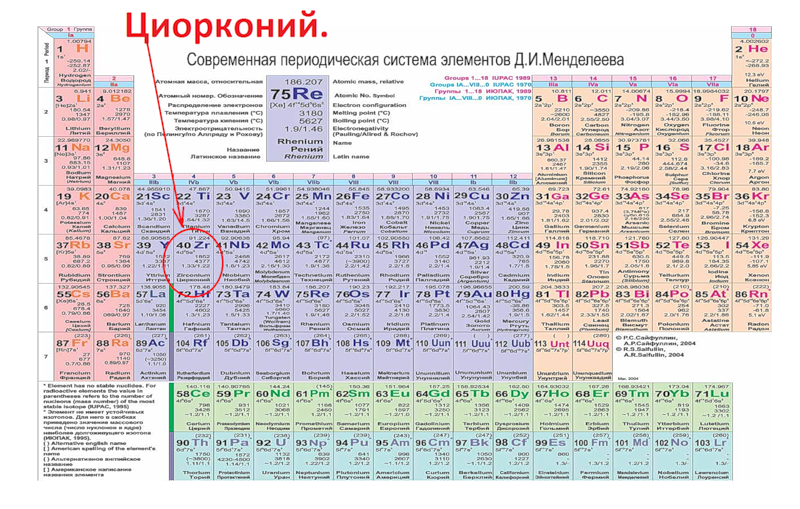
Вариант таблицы используемая в России –7 периодов (горизонтальные ряды) и 8 групп (вертикальные ряды). Группы делятся на главные (заполняются s- и p- электроны внешнего уровня) и побочные (заполняются d-электроны предвнешнего и f-электроны предпредвнешнего уровня).

Номер группы – количество электронов на внешнем уровне (для главной подгруппы) – максимальная положительная степень окисления элемента (кроме кислорода, фосфора и благородных газов).
Электроотрицательность атома, величина, характеризующая способность атома в молекуле притягивать электроны, участвующие в образовании химической связи. Известно несколько способов вычисления Э. Так, согласно Р. Малликену (1935), мерой Э. может служить сумма ионизационного потенциала атома и его сродства к электрону; Л. Полинг предложил (1932) другой, более сложный способ вычисления. Оказалось, однако, что все способы практически приводят к одинаковым результатам.
Степень окисления - численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Изменение свойств
Увеличение
радиуса атома Уменьшается
энергия ионизации Увеличиваются
металлические свойства Уменьшение
электроотрицательности
Уменьшается
радиус атома Увеличивается
энергия ионизации (энергия необходимая
для отрыва 1 электрона) Увеличивается
электроотрицательность Уменьшаются
металлические свойства


рис. Изменение радиусов по периоду и по группе.

рис. Изменение электроотрицательности
&5. Химическая связь
