
- •Вопрос 20 Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Шкала водородного показателя. Индикаторы. Изменение окраски индикаторов в зависимости от реакции среды.
- •Вопрос 23 Классификация окислительно-восстановительных реакций. Приведите примеры реакций каждого типа. Составьте уравнения соответствующих реакций с помощью метода электронного баланса.
- •Вопрос 26 Водородный электрод. Устройство и электродные процессы. Стандартный водородный электрод. Зависимость величины потенциала водородного электрода от рН среды
- •Вопрос 30 Электродные процессы при коррозии металлов. Катодные реакции в кислых, нейтральных и щелочных средах. Чем может быть вызвана электрохимическая гетерогенность поверхности металла?
- •Вопрос 31 Электролиз с растворимыми и нерастворимыми электродами. Порядок разряда ионов на электродах при электролизе. Законы Фарадея. Практическое применение процессов электролиза.
- •Вопрос 34 Способы защиты металлов от коррозии. Неметаллические защитные покрытия. Виды неметаллических защитных покрытий и их применение.
- •Вопрос 35 Способы защиты металлов от коррозии. Электрохимическая защита. Протекторная защита и катодная защита.
Вопрос 23 Классификация окислительно-восстановительных реакций. Приведите примеры реакций каждого типа. Составьте уравнения соответствующих реакций с помощью метода электронного баланса.
Межмолекулярный тип реакции. Если окислитель и восстановительнаходятся в молекулах различных в-в. ( H2S+4O3+H2S-2=S0+H2O) Тип Диспропорционирования или самоокисления-самовосстановления.Когда окислитель и восстановитель представлены одним и тем же в-вом содинаковой степенью окисления( такимдвойственным св-вом обладают неметаллы, кроме F2 и O2). ( Cl20+NaOHàNaCl-+NaCl+5O3+H2O ) Внутримолекулярныйтип. Если в молекуле сложного в-ва содержатся атомы, один из которых явл.окислителем , другой – восстановителем.(N-3H4N+3O2àN20+H2O) Методэлектронного баланса. Последовательность: 1. Составить схему реакции суказанием исходных и образ веществ, отметить элементы, изменяющие в результатереакции степень окисленности, найти окислитель и восстановитель. 2. Составитьсхемы полуреакций окисления и восстановленияс указанием исходных и образующихся реально существующих в условияхреакции ионов и молекул. 3. Уравнять число атомов каждого элемента в левой иправой частях полуреакций; при этом следует помнит, что в водных растворах вреакциях могут участвовать молекулы H2O, ионы H+ или ион ОН-. 4.Уравнятьсуммарное число зарядов в обеих частях каждой полуреакции;для этого прибавить к левойи правой частям полуреакции необходимое числоэлектронов. 5. Подобрать множители (основные коэффициенты) для полуреакций так,чтобы число электронов, отдаваемых при окислении, было равно числу электронов,принимаемых при восстановлении. 6. Сложитьуравнения полуреакций с учетом найденных основных коэффициентов. 7.Расставить коэффициенты в уравнении реакции.
Вопрос 24 Характер взаимодействия металлов с водой, растворами солей, щелочей и кислот. Особенности взаимодействия металлов с концентрированной серной кислотой и азотной кислотой. Как реагирует железо с сильно разбавленной, разбавленной и концентрированной азотной кислотой? Составьте уравнения соответствующих реакций.
2. Взаимодействие с водой . Все щелочные металлы реагируют с водой , восстанавливая ее до водорода. Активность взаимодействия металлов с водой увеличивается от лития к цезию.
2Na + 2H2O ® 2NaOH + H2-
2Li + 2H2O ® 2LiOH + H2-
3. Взаимодействуют с кислотами . Щелочные металлы взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода:
2Na + 2HCl ® 2NaCl +H2
Концентрированную серную кислоту восстанавливают главным образом до сероводорода:
8Na + 5H2SO4 ® 4Na2SO4 + H2S + 4H2O
При этом возможно параллельное протекание реакции восстановления серной кислоты до оксида серы (IV) и элементарной серы.
При реакции щелочного металла с разбавленной азотной кислотой преимущественно получается аммиак или нитрат аммония, а с концентрированной - азот или оксид азота (I):
8Na +10HNO3(разб.)® 8NaNO3 + NH4NO3 + 3 H2O
8K +10HNO3(конц.)® 8KNO3 + NO2 + 5H2O
Однако, как правило, одновременно образуется несколько продуктов.
4. Взаимодействие с оксидами металлов и солями . Щелочные металлы вследствие высокой химической активности могут восстанавливать многие металлы из их оксидов и солей:
BeO +2Na ®Be + Na2O
CaCl2 + 2Na® Ca + 2NaCl
Серная кислота (H2SO4)
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам .
Азотная кислота (HNO3)
Особенностью азотной кислоты является то, что азот, входящий в состав NO3- имеет высшую степень окисления +5 и поэтому обладает сильными окислительными свойствами. Максимальное значение электродного потенциала для нитрат-иона равно 0,96 В, поэтому азотная кислота – более сильный окислитель, чем серная . Роль окислителя в реакциях взаимодействия металлов с азотной кислотой выполняет N5+. Следовательно, водород H2 никогда не выделяется при взаимодействии металлов с азотной кислотой (независимо от концентрации).
Pb + 2 HCl → PbCl2↓ + H2↑
НИКОГДА не образуется водород
В зависимости от активности металла и концентрации кислоты могут образовываться различные производные азота.
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы—в оксиды. Концентрированная HNO3 пассивирует некоторые металлы.
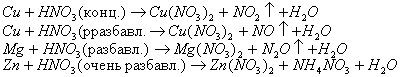
Вопрос 25 Возникновение скачка потенциала на границе металл - раствор соли металла. Стандартный электродный потенциал. Ряд стандартных электронных потенциалов металлов. Какие выводы можно сделать исходя из положения металла в ряду?
В силу того, что у атомов поверхностиметаллов валентные возможности реализованы не полностью, и на границе металл-электролит возникает промежуточная фаза, состоящая из гидратированных атомовметалла. [Me*nH2O]= [Me*nH2O]+ne. Рано или поздно между анодным и катодным процессомустановится равновесие. В силу стремления металла кокислению к моментуравновесия некоторое кол-во ионовметаллаостается в растворе электролита,а избыточное количество электронов - в металле. На границе раздела возникаетскачок потенциала. Скачок потенциала, который возникает на границе раздела фаз,при переходе металла из вакуума в раствор электролита, наз. электродным потенциаломметалла.Это – термодинамическаяхарактеристика системы металл-электролит. Чем более активный металл, тем онбольше стремиться к окислению, тем больше будет величина скачка потенциала награнице раздела фаз, тем более будет отрицательный электродный потенциал.Величину электродного потенциала измеряют путем сравнения: определяют разностьпотенциалов между рассматриваемой системой металл-электролит (рабочий электрод)и другой подобной рабочей системой, потенциал которой принят за ноль. Когда каждаяреакция(окисл\восст) протекает в гальваническом элементе или при электролизе токаждая реакция происходит на соотв. электроде, то такие полу-реакции называютсяэлектродными процессами. Ряд стандартных электродных потенциаловрасполагает Ме в порядке возрастания величин СЭП. Выводы:1) Чем левеерасположен Ме в ряду и чем меньше величина его электроотриц потенциала, тем онхимически активнее, тем легче Ме окислить, тем труднее воостанавливаются егоионы.2)Чем правее расположен Ме в ряду и чем больше величина его электроотрицпотенциала, тем он химически менее активен, тем легче восстанавливаются егоионы.3)Все Ме, стоящие до Н способны вытеснять водород из разбавл кислот,стоящие правее – не вытесняют.4)Чем дальше друг от друга расположены Ме в ряду,тем большую ЭДС будет иметь состоящий из них гальванический элемент.5) Ме ,стоящий в ряду до Mg,вытесняет H из H2O 6)Каждый Ме этого ряда вытесняет стоящий за ним Ме из растворових солейВопрос29. Водородный электрод. Устройство и электродные процессы. Стандартныйводородный электрод. Зависимость величины потенциала водородного электрода отрН среды.
водородный электрод – платиновая пластинка, электролитическипокрытая губчатой платиной и погруженная в раствор кислоты, через которыйпропускается водород.. 2H++2e=H20Потенциал металла, измеренный при стандартных условиях относительностандартного водородного электрода (водородный электрод при н.у.) сравненияназ. стандартным электродным потенциалом. Стандартный электродный потенциалметалла – равновесный потенциал Ме, находящегося в контакте с растворомсобственной соли при стандартных условиях и измеренный относительностандартного водородного электрода
