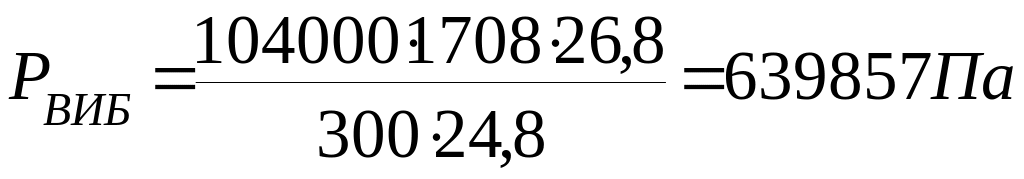- •5.17020301 „Організація та техніка протипожежного захисту ”,
- •5.17020301 „Організація та техніка протипожежного захисту ”,
- •5.17020301 „Організація та техніка протипожежного захисту ”
- •1. Загальні методичні вказівки 7
- •1. Загальні методичні вказівки
- •Змiст дисципліни
- •1 Основи процесів горіння
- •1.1 Загальні відомості про природу процесу горіння
- •Лабораторна робота 1.
- •Лабораторна робота 2
- •1.2 Матеріальний і тепловий баланс процесу горіння
- •1.3 Самоспалахування горючих систем.
- •1.4 Самозаймання речовин і матеріалів.
- •1.5 Примусове займання горючих систем.
- •2. Розвиток процесів горіння
- •2.1. Горіння суміші газів, парів з повітрям.
- •2.3 Горіння твердих речовин.
- •2.4 Горіння пило-повітряних сумішей.
- •2.5 Оцінка горючості речовин і матеріалів
- •3. Властивості і пожежна небезпека горючих речовин.
- •3.1. Властивості та пожежна небезпека вуглеводнів
- •3.2 Властивості та пожежна небезпека оксигенно-нітрогенновмісних органічних сполук.
- •3.4 Властивості та пожежна небезпека полімерів.
- •4. Фізико – хімічні основи розвитку пожеж.
- •Параметри розвитку пожежі.
- •4.2 Особливості розвитку пожеж на відкритих та обмежених просторах.
- •5.1 Способи припинення процесів горіння. Вогнегасні речовини.
- •Методичні вказівки з самостійного вивчення матеріалу і переказу теоретичних питань
- •1 Основи процесів горіння
- •1.1 Загальні відомості про природу процесу горіння
- •1.2 Матеріальний і тепловий баланс процесу горіння
- •1.3 Самоспалахування горючих систем
- •1.4 Самозаймання речовин і матеріалів.
- •1.5 Примусове займання горючих систем
- •2. Розвиток процесів горіння
- •2.1. Горіння суміші газів, парів з повітрям
- •2.3 Горіння твердих речовин
- •2.4 Горіння пило-повітряних сумішей.
- •2.5 Оцінка горючості речовин і матеріалів
- •3. Властивості і пожежна небезпека горючих речовин
- •3.1. Властивості та пожежна небезпека вуглеводнів
- •3.2 Властивості та пожежна небезпека оксигенно-нітрогеновмісних органічних сполук
- •3.3. Властивості та пожежна небезпека елементоорганічних сполук
- •3.4 Властивості та пожежна небезпека полімерів
- •4. Фізико – хімічні основи розвитку пожеж.
- •Параметри розвитку пожежі
- •Особливості розвитку пожеж на відкритих та обмежених просторах
- •5.1 Способи припинення процесів горіння. Вогнегасні речовини.
- •Питання для самоперевірки
- •Методичні вказівки до розв'язування задачі
- •Приклад розв'язку задачі
- •Розв’язування
- •4. Розрахуємо температуру горіння етилацетату:
- •9. Розрахуємо концентраційні межі поширення полум’я етилацетату
- •10. Розрахуємо температурні межі поширення полум’я речовини
- •11. Розрахуємо температуру спалаху етилацетату.
- •12. Знаходимо час утворення нкмпп парів етилацетату
- •Завдання для контрольної роботи і методичні вказівки до їх виконання
- •Завдання для виконання контрольної роботи Теоретичні питання:
- •Лабораторні роботи і методичні вказівки до їх виконання Загальні вимоги
- •Правила техніки безпеки при проведенні лабораторних робіт
- •Лабораторна робота №1.
- •Теоретична частина
- •Практична частина
- •Хід роботи
- •Контрольні питання:
- •Лабораторна робота № 2.
- •Теоретична частина
- •Хід роботи
- •Контрольні питання:
- •Лабораторна робота 3.
- •Теоретична частина.
- •Хід роботи
- •Контрольні питання
- •Орієнтовний перелік питань підготовки до екзамену.
- •Умовні позначення, які прийнятті в посібнику.
- •Література
- •Додатки
Методичні вказівки до розв'язування задачі
Перед розв'язуванням задачі необхідно вивчити відповідний теоретичний матеріал), знаючи фізичну суть параметрів пожежної небезпеки, які підлягають розрахунку.
Уважно прочитати умову задачі і переписати її в зошит. Виписати в стовпчик дані для свого варіанту. Відомі величини підкреслити, під рискою записати, що вимагається визначити. Посередині рядка під умовою задачі записати «Розв’язування», а потім по пунктам послідовно розв’язувати задачу.
Під час розв'язування необхідно показати весь хід розв'язку і математичні перетворення. Проміжні і кінцеві величини, які отриманні під час розв'язування, повинні супроводжуватись одиницями вимірювання. В кінці розв'язку задачі необхідно проаналізувати отриманні результати, щоб виключити нереальні величини, які підлягають визначенню.
Обчислення необхідно проводити до сотих долів числа з розрахунком тепловмісту - до цілого числа.
Під час розв'язування задачі на ЕВМ прикласти програму і роздруківку розв'язку.
Приклад розв'язку задачі
Дано:
Г.Р. – етилацетат Vn = 200м3
СНзСООС2Н5 – рідина S випаровування = 3м2
Рн = 104000 Па
tu = 270 С = 300К
=1,5
G = 1,6 г/м2 . с
Визначити: Vп, Vпг, % склад П.Г., Qн, tгор, Снас, Сст, Рвиб, НКМПП, ВКМПП, НТМПП, ВТМПП, tcп, вип.
Розв’язування
1. Розрахуємо об’єм повітря, який необхідний для згорання 1кг етилацетату:
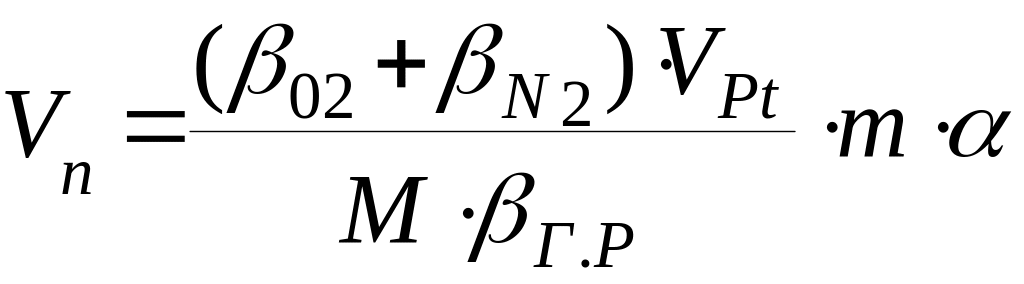
де: β02, βN2, βгр – кількість або число кіломолів О2, N2 і горючої речовини за рівнянням реакції горіння етилацетату;
Vpt – об’єм кіломоля будь – якого газу при заданих умовах;
М – молекулярна маса горючої речовини;
m – маса горючого (розрахунок ведеться на 1кг).
Ця формула отримана із аналізу рівняння реакції горіння.
1.1 Складемо рівняння реакції горіння етилацетату на повітрі:
СН3СООС2Н5 + 5О2 + 5 . 3,76N2 = 4CO2 + 4Н2О + 5 .3,76N2
Звідси β02 = 5;
βN2 = 5 . 3,76
1.2 Визначаємо об’єм газу при заданих умовах
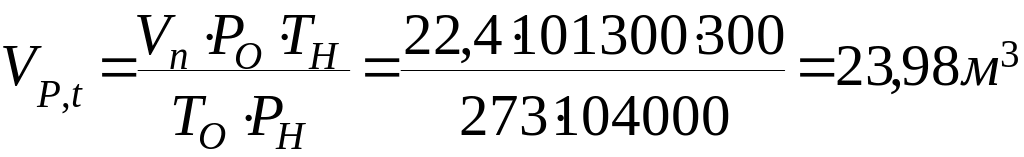
1.3 Визначаємо масу кіломоля етилацетату
![]()
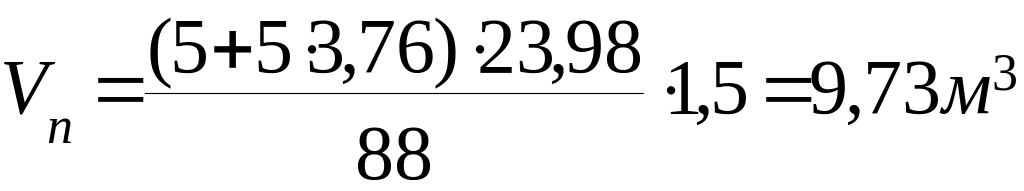
1.4
Розрахуємо об’єм і процентний склад продуктів горіння 1кг етилацетату:

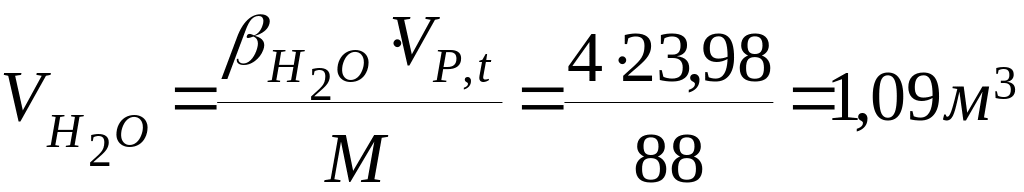

![]() - кількість
кіломолів азоту, що знаходяться в
надлишку повітря:
- кількість
кіломолів азоту, що знаходяться в
надлишку повітря:
![]()
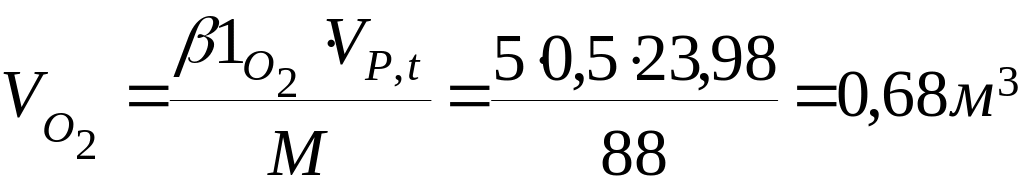
β1о2 - кількість кіломолей надлишкового кисню
![]()




3. Розрахуємо нижчу теплоту згорання етилацетату за формулою Д.І. Мендєлєєва:

д![]() е:
відсотковий вміст
відповідно карбону, гідрогену, оксигену,
сульфуру та вологи горючої речовини.
е:
відсотковий вміст
відповідно карбону, гідрогену, оксигену,
сульфуру та вологи горючої речовини.
3.1 Розрахуємо відсотковий вміст етилацетату, вважаючи молекулярну масу за 100%.
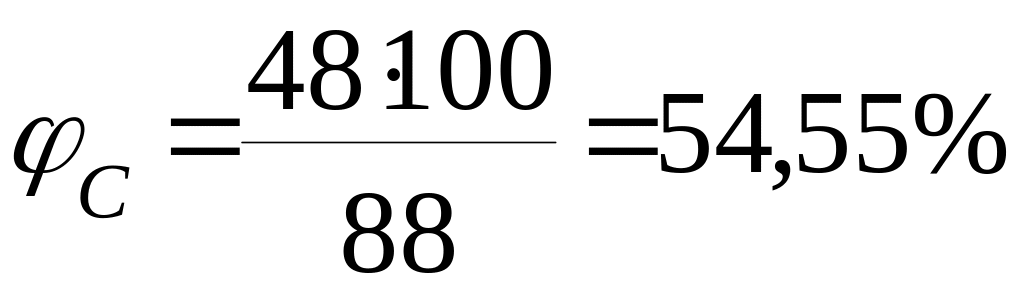
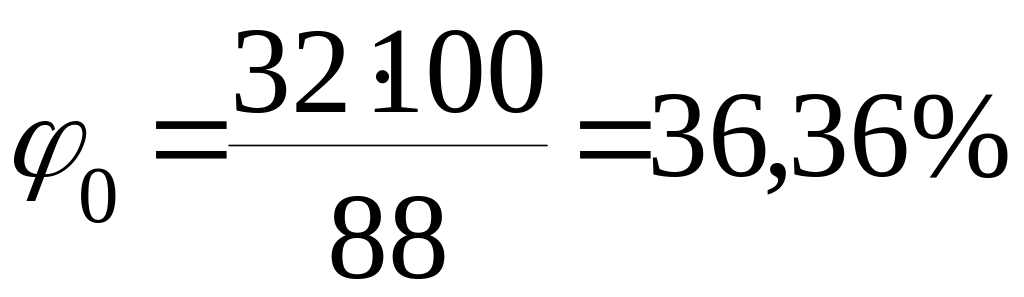
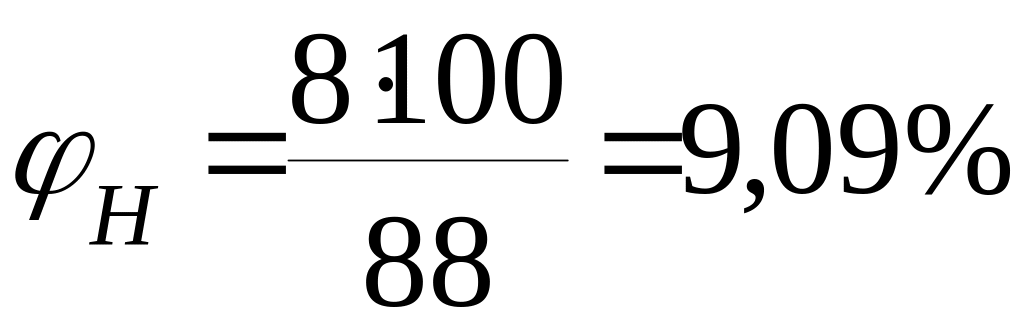
Тоді
![]()
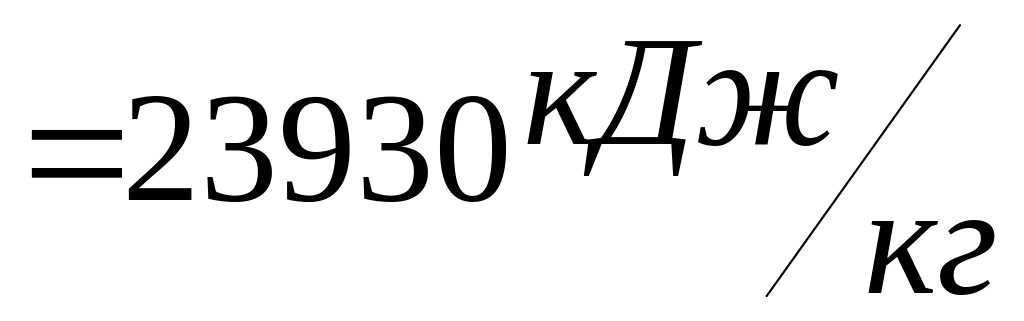
4. Розрахуємо температуру горіння етилацетату:
4.1.Визначаємо середній тепловміст одного м3 продуктів горіння

4.2 Враховуючи, що продукти горіння в основному (на 72,86%) складаються із азоту, приймаємо tГОР = 15000 С
![]()
![]()
![]()
![]()
![]()
![]() ;
;
4.3 Так як тепловміст продуктів горіння не може перевищувати тепловиділення (Qн), а Q1500 > Qн, приймаємо tГОР = 14000С і розрахунок повторюємо
![]()
![]()
![]()
![]()
![]()
![]() ;
;
4.4 Дійсну температуру горіння знаходимо інтерполяцією, приймаючи тепловміст продуктів горіння у вибраному інтервалі від 14000 С до 15000 С постійною
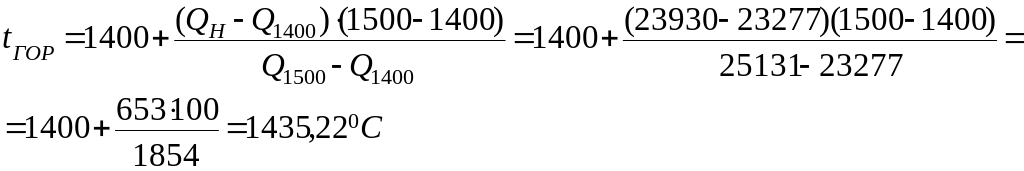

5. Визначаємо густину пари етилацетату по відношенню до густини повітря:

М – молекулярна маса етилацетату
Mn = 29 – середня маса кіломоля повітря;
тобто пари етилацетату в 3,03 рази важчі за повітря.
6. Розрахуємо концентрацію насиченої пари
6.1 За таблицею або номограмою знаходимо тиск насиченої пари етилацетату при 300 К. Він дорівнює приблизно 1425 Па.
6 .2.
Концентрація парів в % за об’ємом
складає:
.2.
Концентрація парів в % за об’ємом
складає:
6.3.Переведемо об’ємну концентрацію в масову:

7. Розрахуємо стехіометричну концентрацію пари етилацетату в суміші з повітрям, вважаючи об’єм всієї суміші за 100%
7.1.у відсотках за об’ємом
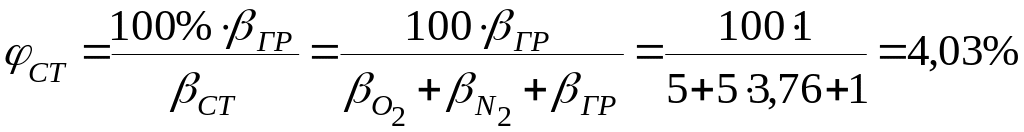
7.2. в грамах на м3

8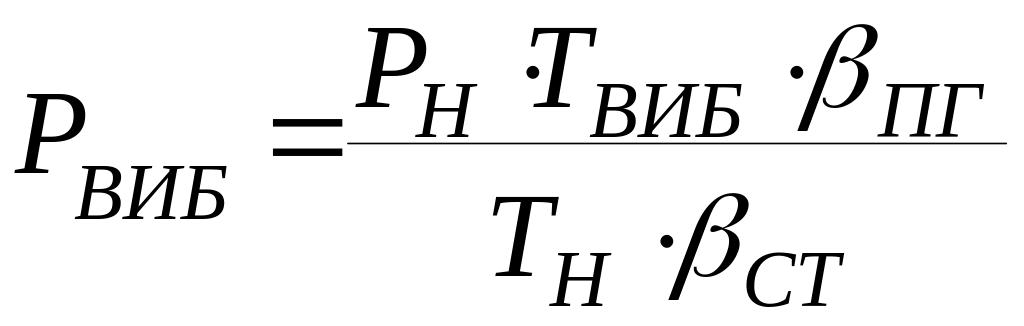 .
Розрахуємо тиск від часу вибуху парів
етилацетату на стехіаметричній
концентрації при tВИБ = tГОР
.
Розрахуємо тиск від часу вибуху парів
етилацетату на стехіаметричній
концентрації при tВИБ = tГОР
![]()
де:
![]()
![]()
βст = βгр + βо2 + βN2 = 1+5+5 ∙ 3,76 = 24,8 кмоль