
- •Электрофизиология кардиомиоцита
- •Глава 1 Каналы и токи кардиомиоцита
- •1.1. Натриевые каналы и токи
- •1. Изоформы α-субъединиц потенциал зависимых натриевых каналов
- •Натриевого канала (по n. Ogata и y Ohishi [67])
- •1.2. Калиевые каналы и токи
- •2. Потенциал зависимые калиевые токи/каналы кардиомиоцитов млекопитающих
- •3. Субъединицы Kvα: корреляция
- •4. Номенклатура генов, кодирующих
- •5. Добавочные субъединицы каналов Kv
- •1.2.1. Молекулярные корреляты транзиторных токов калия в сердце
- •6. Субъединицы каналов Kir
- •1.2.2.Быстрый транзиторный калиевый ток(Ito,f)
- •1.3. Строение и функционирование
- •1.4. Распределение ионов хлора
- •1.5. Кальциевые каналы и токи
- •1.5.1.Фоновые кальциевые каналы
- •1.5.2. Кальциевые каналы l-типа
- •1.5.2.1. Строение кальциевого канала l-типа
- •1.5.3. Кальциевая атф-аза
- •1.6. Равновесные потенциалы
- •1.7. Ионные основы электрической активности сердца
- •Глава 2 Потенциал действия в кардиомиоцитах
- •2.1. Фазы потенциала действия
- •7. Локализация основных субъединиц ионных токов в сердце (по Schram g. [79])
- •Потенциала кардиомиоцита желудочков во времени (по g. Schram [79])
- •2.2. Ионные механизмы формирования потенциала действия в синоатриальном узле
- •2.3. Ионные механизмы формирования потенциала действия в кардиомиоцитах предсердия
- •Потенциала действия в клетках предсердия
- •2.4. Ионные механизмы формирования потенциала действия в кардиомиоцитах атриовентрикулярного узла
- •Потенциала действия в клетках атриовентрикулярного узла (по g. Schram [79])
- •2.5. Ионные механизмы формирования потенциала действия в кардиомиоцитах пучка Гиса и волокон Пуркинье
- •Глава 3
- •Глава 4 Вегетативная регуляция работы сердца
- •Путей и путей, опосредованных ионами кальция в формировании инотропных и лузитропных эффектов в кардиомиоците (по m. Zaugg [102])
- •4.1. Влияние катехоламинов на формирование потенциала действия кардиомиоцитов
- •4.2. Мускариновая регуляция ионных каналов сердца
- •Библиографический список
- •Оглавление
- •У чебное издание
- •Электрофизиология кардиомиоцита
- •428000, Чебоксары, ул. К. Маркса, 38
- •428000, Чебоксары, ул. К. Маркса, 38
1. Изоформы α-субъединиц потенциал зависимых натриевых каналов
Наименование |
Символ гена |
Локализация в хромосоме* |
Чувствительность к ТТХ ** |
Основная локализация |
Nav 1.1 |
SCN1A |
M:2 H:2q24
|
S |
ЦНС, ПНС |
Nav 1.2 |
SCN2A |
M:2 H:2q23-24
|
S |
ЦНС |
Nav 1.3 |
SCN3A |
M:2 H:2q24
|
S |
ЦНС (эмбрион) |
Nav 1.4 |
SCN4A |
M:11 H:17q23-25
|
S |
Скелетная мышца |
Nav 1.5 |
SCN5A |
M:9 H:3p21
|
R |
Сердечная мышца |
Nav 1.6 |
SCN8A |
M:15 H:12q13 |
S |
ЦНС, ПНС, глия, узлы Ранвье |
Nav 1.7 |
SCN9A |
M:2 H:2q24
|
S |
ПНС (клетки Шванна) |
Nav 1.8 |
SCN10A |
M:9 H:3p22-24 |
R |
ПНС (сенсорные нейроны) |
Nav 1.9 |
SCN11A |
M:9 H:2p21-24
|
R |
ПНС |
Nax |
SCN6A (SCN7A) |
M:2 H:2q21-23 |
R |
Сердце, глия, ПНС, гладкие мышцы |
Примечание: *M – мышь, Н- человек; ** S – чувствительность, R – устойчивость, ТТХ – тетродотоксин, ЦНС – центральная нервная система, ПНС – парасимпатический отдел вегетативной нервной системы.
Хотя, как следует из таблицы 1, имеется ряд гомологичных α-субъединиц, Nav 1.5 является основной субъединицей, экспрессированной в миокарде млекопитающих. Для этой субъединицы характерна быстрая активация и инактивация, а также отсутствие чувствительности к ТТХ. Натриевые каналы, содержащие данную субъединицу, обуславливают быструю деполяризацию в кардиомиоцитах желудочков, предсердий и в клетках волокон Пуркинье. В то же время, в некоторых исследованиях было выявлено наличие и других изоформ α-субъединиц в натриевых каналах этих клеток: были обнаружены Nav 1.1, Nav 1.3 и Nav 1.4. В течение фазы плато потенциала действия кардиомиоцита около 99 % каналов Nav инактивированы. Мутация в гене SCN5A, связана с синдромом синдрома длинного интервала QT (LQT3) и приводит к нарушению инактивации Nav. В результате последнего амплитуда натриевого тока увеличивается и происходит удлинение потенциала действия. Мутация в гене SCN5A также связана с другим нарушением ритма – синдромом Бругада. В отличие от LQT, синдром Бругада характеризуется уменьшением деполяризующего натриевого тока и, как следствие, замедлением скорости быстрой деполяризации. Уменьшение величины тока Nav может также влиять на амплитуду потенциала действия и реполяризацию в фазу 1. Хотя большинство исследований Nav каналов в сердце посвящены Nav 1.5 α-субъединице, сейчас стало ясно, что функционирование каналов Nav в клетках сердца отражает взаимодействие различных белков, в том числе добавочных и регуляторных. Все доступные на настоящий момент сведения указывают на то, что канал Nav содержит в своём составе центральную субъединицу α и одну или две субъединицы β. Выявлено три различных гена субъединицы β Nav – SCN1b, SCN2b и SCN3b), которые кодируют белки Navβ1, Navβ2, Navβ3, соответственно. Все эти три субъединицы Navβ экспрессируются в сердце. Однако функциональная роль субъединиц Navβ не совсем ясна. Показано, что экспрессия SCN2b может играть определенную роль в контроле за проницаемостью Nav для ионов Сa2+ . Давно установлено, что для нормального функционирования Nav в миокарде требуется интактный актиновый цитоскелет. Важная функциональная роль активнового цитоскелета в регуляции Nav была показана в опытах на мышах: особи с нарушением строения анкерина (структурный белок, который фиксирует ионные каналы на клеточной мембране) имели нарушенную электрическую активность сердца, связанную с нарушением воротного механизма Nav и уменьшением уровнем экспрессии этого канала на поверхности клетки. В современной науке имеет место всё увеличивающийся объём данных о том, что Nav каналы сердечно-сосудистой системы напрямую и/или опосредованно взаимодействуют с актиновым цитоскелетом и рядом регуляторных и сигнальных молекул. Это взамолействие может играть существенную роль в регуляции активности каналов и/или модулировать свойства канала. Так, сообщается, что синтрофины (белки, обеспечивающие связь между актиновым цитоскелетом и белками цитоплазматической мембраны) напрямую взаимодействуют с субъединицей α Nav канала. В кардиомиоцитах экспрессия каналов Nv также регулируется напрямую через β-адренорецептор и ассоциированный с ним белок Gs – активация Gsα приводит к усилению экспрессии каналов Nav [55; 76; 88]. Усиление деятельности каналов Nav под влиянием такой активации β-адренорецепторов может происходить как напрямую (посредством Gs), так и опосредованно – через систему вторичного посредника аденилатциклаза-цАМФ и протеинкиназу А (РКА) [56].
Представленные в работе H. U. Weigt и соавторов данные свидетельствуют о том, что метоксамин (стимулятор α –адренергического рецептора) уменьшает ток Na+ через мембрану [95].
Другим
механизмом регуляции деятельности
каналов Nav
является изменение активности
протеинкиназы С (РКС): введение активаторов
РКС (форбол 12-миристат 13-ацетат и
![]() V1-7)
приводит к подавлению INa
на 31±5% и 44±8%, соответственно [97].
V1-7)
приводит к подавлению INa
на 31±5% и 44±8%, соответственно [97].
Общая схема строения натриевого канала приведена на рисунке 3.
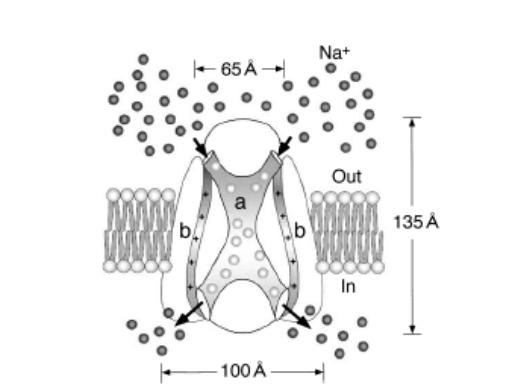
Рис. 3 Схема структуры потенциал зависимого
