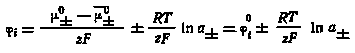- •Ионно – дисперсное состояние радионуклида в водных средах.
- •Молекулярно – дисперсное состояние радионуклидов в водных средах.
- •Коллоидно – дисперсное состояние радионуклида в водных средах.
- •4) Методы определения состояния радионуклидов.
- •5)Состояние радионуклида в твердых и газообразных средах
- •Изотопный обмен. Его сущность.
- •7)Реакции изотопного обмена их класификация
- •8) Механизм протекания изотопного обмена
- •9) Особенности реакций изотопного обмена
- •10) Носители. Их класификация
- •11) Область применения изотопного обмена
- •12) Специфичный изотопный и не изотопный носитель
- •13) Неспецифический неизотопный носитель
- •14) Сущность метода радиоактивных индикаторов и его применение
- •19) Изоморфная сокристализация (изоморфизм)
- •20) Изодиморфная сокристализация (изодиморфизм)
- •21) Сокристализация с оброзованием аномально – смешаных кристалов
- •22) Равновесное разделение микрокомпонента при сокристализации . Закон в.Г. Хлопина
- •24) Понятие нижней и верхней граници смешиваемости при сокристализации.
- •25) Первычная обменная адсорбция
- •26) Первичная потенциалообразующая адсорбция
- •27)Вторичная обменная адсорбция
- •28) Сущность экстракции. Классификация экстракционных систем
- •29) Общее понятия и закономерности экстракции
- •30) Экстракция нейтральными экстрагентами
- •31) Экстракция кислыми экстрагентами
- •32) Экстракция внутрекомплексных соединений
- •Ацетилацетон (аа)
- •Теноилтрифторацетон (нтта)
- •33) Экстракция основными экстрагентами
- •34) Экстракция оксониевыми соединениями
- •35) Хроматография. Её сущность . Классификация хроматографических систем
- •36) Фронтальная хроматография
- •37) Виды элюентов. Эллюэнтный метод хроматографии
- •38) Ионо обменная хроматография
- •39) Сущность ионнообменной хроматографии
- •40) Иониты используемые в хроматографии. Строение и классификация.
- •41)Основные характеристики ионитов ядерного класса (сое, дое радиационная стокйкость и другое)
- •42)Факторы влияющие на ионный обмен
- •43) Осадочная хроматография
- •Принци осуществления
24) Понятие нижней и верхней граници смешиваемости при сокристализации.
25) Первычная обменная адсорбция
Первичная адсорбция — адсорбция в поверхностном слое кристалла. В ней могут принимать участие только ионы, изотопные или изоморфные ионам, образующим кристаллическую решетку адсорбента
Первичная обменная адсорбция является результатом стехиометрического обмена ионами между поверхностью кристалла и раствором и не приводит к изменению заряда поверхности.
????
26) Первичная потенциалообразующая адсорбция
Для радиохимии более важной является потенциалобразующая первичная адсорбция. В основе этого вида адсорбции лежит процесс переноса собственных ионов адсорбента из раствора на поверхность кристалла, приводящий к избытку этих ионов на поверхности и возникновению скачка потенциала.
Представим себе кристаллический осадок, находящийся в его насыщенном растворе. Допустим, что значение химического потенциала одного из ионов на поверхности кристалла меньше химического потенциала этого иона в насыщенном растворе:
± < ±, |
(6.1) |
Тогда при погружении кристаллов в раствор часть заряженных ионов перейдет из раствора на поверхность кристалла, образуя внутреннюю обкладку двойного слоя. При этом совершается работа переноса электрического заряда из раствора на поверхность кристалла:
± = ± - 0± = 0± ± RT lna± - 0± = zFi, |
(6.2) |
где 0± и 0± — стандартные химические потенциалы ионов соответственно в растворе и на поверхности кристалла; а — активная концентрация иона в растворе; z — заряд иона; F — постоянная Фарадея; i — ионная часть скачка потенциала на границе раздела фаз. Тогда
|
(6.3) |
где a± m±.
Значение заряда на поверхности кристалла может быть рассчитано по формуле
Q = Ci |
(6.4) |
где С — емкость двойного слоя.
Вместе с тем этот заряд равен:
Q = NzF |
(6.5) |
где N — количество избыточных ионов на поверхности (в моль).
Из соотношений (6.3) и (6.5) следует, что
|
(6.6) |
Из соотношений (6.3) и (6.6) видно, что скачок потенциала и количество избыточных ионов на поверхности зависят от концентрации потенциалобразующих ионов в растворе. При работе с микроколичествами радиоактивных элементов их адсорбцией по этому механизму можно пренебречь. Однако знание закономерностей первичной потенциалобразующей адсорбции позволяет регулировать заряд поверхности адсорбента, определяющий величину вторичной обменной адсорбции.
\
27)Вторичная обменная адсорбция
Вторичная обменная адсорбция является результатом обмена ионов во внешней обкладке двойного электрического слоя носителя на одноименно заряженные ионы, находящиеся в растворе.
Рассмотрим наиболее простой случай вторичной обменной адсорбции — на поверхности ионных кристаллов. Нарушение стехиометрии на поверхностном слое кристалла за счет первичной потенциалобразующеи адсорбции приводит к соответствующему нарушению стехиометрии в прилегающем слое раствора — к возникновению внешней обкладки двойного слоя. Это означает, что в прилегающем слое раствора концентрируются ионы со знаком заряда, противоположным знаку заряда поверхности (компенсирующие ионы). Если осадок неспецифического носителя находится в его насыщенном растворе, содержащем ионы радиоактивного элемента (или радиоактивного нуклида), то в образовании внешней обкладки двойного слоя принимают участие и эти ионы.
Перенос ионов радиоактивного элемента из объема раствора во внешнюю обкладку двойного электрического слоя получил название вторичной обменной адсорбции.
Так, процесс вторичной адсорбции 234Th4+ на осадке BaSO4 можно представить следующей схемой:
В процессе вторичной адсорбции могут принимать участие все находящиеся в растворе ионы со знаком заряда, противоположным знаку заряда поверхности кристалла (т. е. одинаковым с ионами, находящимися во внешней обкладке двойного слоя).
Если наряду с ионами радиоактивного элемента AzA в растворе находятся ионы других электролитов: ВzB, CzC, YzY (где zA, zB, zC, ... zY — их заряд), то процессы конкурентного замещения ионов радиоактивного элемента всеми остальными одноименно заряженными ионами можно представить следующим образом:
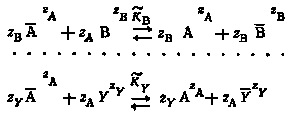
Черта над символом указывает местонахождение ионов во внешней обкладке двойного слоя.
KB .. KY— концентрационные константы равновесия соответствующих реакций.
Полагая, что все ионы, кроме ионов радиоактивного элемента, одновалентны, уравнения реакций можно записать следующим образом:
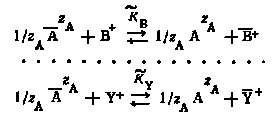
В результате взаимодействия между ионами, находящимися во внешней обкладке двойного слоя и в растворе, достигается состояние равновесия.