
- •1. Актуальность темы:
- •2. Конкретные цели
- •3. Базовый уровень подготовки
- •4. Задания для самостоятельной работы.
- •5. Организация учебного материала
- •Классификация пиелонефрита у детей (приказ мз Украины № 365 от 20.07.2005)
- •Основные диагностические критерии имс у детей
- •Характеристика инфекций мочевой системы
- •Особенности клинической картины пиелонефрита у детей раннего и старшего возраста
- •Лабораторные критерии имп у детей
- •Алгоритм обследования ребенка с имп
- •Внутривенная урография Сканирование с димеркаптоянтарной кислотой
- •Доказательная база в лечении инфекций верхних мочевых путей
- •Доказательная база в лечении инфекций нижних мочевых путей
- •Доказательная база в профилактическом лечении
Доказательная база в лечении инфекций верхних мочевых путей
Клиническая эффективность курсов ступенчатой (внутривенная с переходом на пероральную) и пероральной антибактериальной терапии ПН различной продолжительности (от 7 до 14 дней). Применение антибиотика перорально допускается, начиная уже со второго месяца жизни. При более коротком курсе лечения (7 дней) несколько чаще, чем при пролонгированой терапии (14 дней), сохраняется бактериурия. Вместе с тем короткий курс антибиотикотерапии сопровождается меньшей частотой побочных эффектов. Наиболее оправданным следует считать 10-дневный курс антибактериальной терапии.
Отсутствие положительной динамики на 3-й день лечения свидетельствует об устойчивости данного уропатогенного штамма к назначенному антибиотику или о другом возбудителе заболевания. В этом случае требуется смена антибактериального препарата.
Доказательная база в лечении инфекций нижних мочевых путей
Сравнение эффективности 2-4-дневного курса антибактериальной терапии с 7-14-дневным приемом препаратов у детей с неосложненной инфекцией нижних мочевых путей приведено в анализе 10 исследований (652 ребенка) Кокрановского обзора (M. Michael, E.M. Hodson, J.C. Craig et al.). По клинической эффективности, количеству рецидивов и вероятности формирования антибиотикорезистентности не установлено существенных отличий между коротким и длительным курсами лечения. Таким образом, стартовая терапия острого цистита может проводиться с одинаковой эффективностью в течение от 3 до 14 дней.
У подростков при инфекциях мочевых путей возможно использование фторхинолонов.
Доказательная база в профилактическом лечении
Для профилактики рецидивирующих (3 и более эпизодов в течение года) инфекций мочевых путей показано применение триметоприма/сульфаметаксозола и нитрофурантоинма, что снижает вероятность рецидивов. Низкодозовая (1/3-1/4 от терапевтической дозы) профилактика показана детям младшего возраста, которые уже имели эпизод ПН, при наличии рубцов в почке, мочекаменной болезни, дизурических явлениях и всем девочкам с эпизодом инфекции мочевой системы в анамнезе. Длительность профилактического лечения может составлять до 2 лет.
Для сексуально активных девочек-подростков можно использовать данные о профилактике рецидивов у женщин. Посткоитальная профилактика ципрофлоксацином столь же эффективна, как и ежедневная. Поэтому у женщин, имеющих рецидив инфекций после сексуальных контактов, целесообразнее использовать эпизодическую посткоитальную профилактику.
Не доказана эффективность препаратов клюквы в уменьшении эпизодов инфекций мочевой системы у детей. Отмечается высокая частота прерывания лечения ввиду побочных реакций, вызываемых препаратами клюквы. Не определены оптимальная доза и лекарственная форма (сок, концентрат, таблетки) для профилактической терапии. Не найдено также информативных рандомизированных клинических испытаний, доказывающих эффективность клюквы и ее лекарственных форм в лечении инфекций мочевой системы.
Данные доказательной медицины являются основой для принятия дальнейших решений, однако нередко отстают от возможностей современной антибиотикотерапии и возрастающих пожеланий врачей и пациентов.
Впервые выявленные инфекции мочевой системы, как правило, не требуют специализированной нефрологической/урологической помощи, и дети получают лечение у педиатра/семейного врача. В связи с этим для стартовой терапии и профилактического лечения чаще назначают 2-3 наиболее используемых препарата. Неэффективность этой терапии или развитие рецидива заболевания зачастую свидетельствуют об осложненном течении инфекции. В этом случае целесообразно направление ребенка/подростка к специалисту (нефрологу, урологу) для проведения более углубленной диагностики и подбора индивидуализированного лечения.
Исходя из вышеизложенного, можно сформулировать следующие общие рекомендации по лечению инфекций мочевой системы у детей:
1. В амбулаторной практике лечение неосложненного ПН у детей может проводиться путем назначения антибиотика (цефалоспорина 2-3-й генерации, защищенного пенициллина) перорально длительностью 10 дней. При наличии факторов риска в последующем целесообразно использовать профилактическое лечение уроантисептиком (Бисептолом, фурадонином) однократно на ночь в дозе 1/3-1/4 от терапевтической, либо посткоитальную профилактику Ципринолом 0,25, либо фитотерапию длительностью до одного года.
2. При осложненном течении острого ПН целесообразно стационарное лечение с использованием ступенчатой антибактериальной терапии длительностью 10-14 дней с последующим профилактическим лечением низкими дозами уроантисептика.
3. В терапии неосложненных инфекций нижних мочевых путей достаточным является 3-5-дневный курс лечения, при развитии рецидива следует сменить антибактериальный препарат и увеличить продолжительность его применения до 5-10 дней с последующей профилактической терапией уроантисептиком либо фитопрепаратом длительностью 3-6 месяцев. При этом необходимо провести тестирование на наличие заболеваний, передающихся половым путем (уреаплазмоза, хламидиоза, генитального микоплазмоза, трихомониаза).
4. При осложненных инфекциях верхних и нижних мочевых путей нередко требуется длительная антибактериальная терапия с учетом возможной специфической флоры, аутовакцинацией, последующим профилактическим лечением и совместным ведением пациента с урологом.
В остром периоде пиелонефрита при выраженном синдроме эндогенной интоксикации показана инфузионно-корригирующая терапия. Состав и объем инфузионной терапии зависит от состояния больного, показателей гомеостаза, диуреза и других функций.
Терапия обструктивного пиелонефрита проводится совместно с детским урологом. Решается вопрос о показаниях к оперативному вмешательству. I-II и III степени ПМР многие годы подвергаются консервативному ведению, в основе которого лежит главным образом длительная профилактика уросептиками. Мероприятия, направленные на нормализацию функции нижних мочевых путей, являются частью лечения больного с ПМР. В последние годы показаниями к оперативному лечению ПМР служат высокая степень рефлюкса (IV-V) и непрерывно-рецидивирующее течение пиелонефрита.
После антибактериальной терапии можно назначить сборы трав, обладающих антисептическим, регенераторным и мочегонным свойствами. Показана щелочная минеральная вода (Смирновская, Ессентуки 20 и др.).
Профилактика. С целью профилактики осложнений ИПМ семейным врачам и/или участковым педиатрам среди наблюдаемых детей необходимо выделять группы риска по ИМП, особенно у новорожденных и грудных детей и при необходимости консультировать таких детей у детского уролога и нефролога. В эту группу должны быть включены все дети с пренатально установленными обструктивными уропатиями, с наследственной предрасположенностью к ИМП, задержкой роста и гипертензией, недоношенные, дети с множественными стигмами дисэмбриогенеза, часто болеющие, дети с наличием очагов хронической инфекции вне системы мочевыведения (гайморит, вульвовагинит, пневмония и др.), дети с сахарным диабетом. Такие дети должны немедленно обследоваться уже при первом выявлении ИМП или развитии инфекционного заболевания других систем организма (ОРВИ, пневмония, сепсис, острая кишечная инфекция и др.). В спектр диагностических процедур обязательно включать оценку струи мочи (диаметр, прерывистость, учащение или урежение ритма спонтанных мочеиспусканий), рутинный осмотр ребенка с исследованием гениталий и обязательным измерением артериального давления. Изменения в анализах мочи, даже умеренное нарушение функции почек и повышение артериального давления, как правило, говорит о морфофункциональных изменениях в почках.
Прогноз
Прогноз для жизни благоприятный, выздоровление происходит в 80% случаев. Летальные исходы редки, в основном у детей раннего возраста при развитии таких осложнений, как сепсис, апостематозный нефрит, карбункул почки, воспаление паранефральной клетчатки. Все дети, перенёсшие острый пиелонефрит, не менее 3 лет находятся на диспансерном учёте с ежемесячным контрольным исследованием мочи, страдающие хроническим пиелонефритом – до момента передачи во взрослую поликлинику. Бактериологический посев мочи необходимо исследовать через 6 недель после окончания лечения для того, чтобы убедиться, что моча стерильна. Учитывая тенденцию ИМС к рецидивированию, целесообразно данное исследование производить вначале ежемесячно, а затем с 3-месячным интервалом в течение 1-2 лет, даже если у ребенка нет никаких симптомов.
Рахитоподобные болезни — группа наследственных тубулопатий, клиническая картина которых в ранние сроки заболевания имитирует рахит, но не связана с дефицитом поступающего в организм витамина D; их ведущим синдромом являются аномалии скелета (почечные остеопатии).
Патогенетические механизмы формирования первичных (наследственных) тубулопатий связывают со следующими факторами: генетически детерминированными нарушениями структуры мембранных белков-носителей; энзимопатиями наследственно обусловленной недостаточностью ферментов, обеспечивающих активный мембранный транспорт (см. Ферментопатии); изменением чувствительности рецепторов клеток канальцевого эпителия к действию гормонов; изменениями общей структуры цитомембран клеток (см. Мембраны биологические) при дисплазиях, в происхождении которых определенная роль принадлежит наследственным факторам. Вторичные тубулопатий возникают в результате повреждения транспортных систем почечных канальцев как при наследственных, так и при приобретенных болезнях обмена в связи с нарушениями метаболизма за пределами нефрона. Они развиваются также при воспалительных заболеваниях почек, что может обусловить значительные дифференциально-диагностические затруднения.
К рахитоподобным болезням относятся витамин-D-резистентный рахит, витамин-D-зависимый рахит, болезнь де Тони — Дебре — Фанкони и почечный тубулярный ацидоз.
Витамин-D-резистентный рахит (семейный гипофосфатемический рахит, фосфат-диабет) характеризуется доминантным типом наследования, сцепленным с полом, возможен также аутосомно-доминантный тип (см. Наследственность). Патогенез метаболических расстройств при этом заболевании сложен и в достаточной степени не исследован. Развитие его связывают с первичным нарушением процессов всасывания кальция и фосфора в кишечнике; с первичным дефектом транспорта неорганических фосфатов в почках и повышением чувствительности эпителия канальцев почек к действию паратгормона; с генетически детерминированным сочетанием этих нарушений; с синтезом в организме фосфатурических метаболитов витамина D и недостаточным образованием 25-оксихолекальциферола в печени.
Заболевание проявляется у детей в 1—2 года, но может начаться в более старшем возрасте. Основными проявлениями болезни служат задержка роста и выраженные прогрессирующие деформации скелета, особенно нижних конечностей (по варусному типу, D-образные искривления; рис. 1, а), что сопровождается нарушением походки ребенка («утиная походка»); значительная болезненность костей и мышц, нередко мышечная гипотония; гипофосфатемия и гиперфосфатурия при нормальном содержании кальция в крови (дифференциально-диагностический признак); выявляемые рентгенологически рахитоподобные изменения костей, преимущественно нижних конечностей; сохранности интеллекта у больных детей.
Витамин-D-резистентный рахит отличается выраженным клиническим полиморфизмом. В зависимости от сроков манифестации, клинико-биохимических особенностей, чувствительности и характера ответной реакции на витамин D выделяют 4 клинико-биохимических варианта заболевания. Первый вариант характеризуется ранней (на первом году жизни) манифестацией, незначительной степенью костных деформаций, гипофосфатемией, гиперфосфатурией, повышением уровня паратгормона в крови, хорошей переносимостью витамина D. Второй вариант отличается более поздней (на втором году жизни) манифестацией, выраженными костными изменениями, гипофосфатемией, значительной гиперфосфатурией, резистентностью к высоким дозам витамина D. Третьему варианту присущи поздние сроки проявления заболевания (в 5—6-летнем возрасте), тяжесть поражений скелета, выраженная гипофосфатемия, значительное снижение абсорбции фосфора в кишечнике при нормальной или незначительной гиперфосфатурии; отмечается также нечувствительность к витамину D. Четвертый вариант характеризуется манифестацией на втором году жизни, умеренной степенью костных деформаций, повышенной чувствительностью к витамину D и склонностью к развитию клинико-биохимической картины гипервитаминоза D (рвота, тошнота, жажда, гиперкальциемия, гиперкальциурия и др.) в ответ на небольшие дозы витамина D. Клинический полиморфизм, особенности патогенеза и метаболических расстройств, широкий диапазон ответной реакции на витамин D свидетельствуют о генетической гетерогенности витамин-D-резистентного рахита.
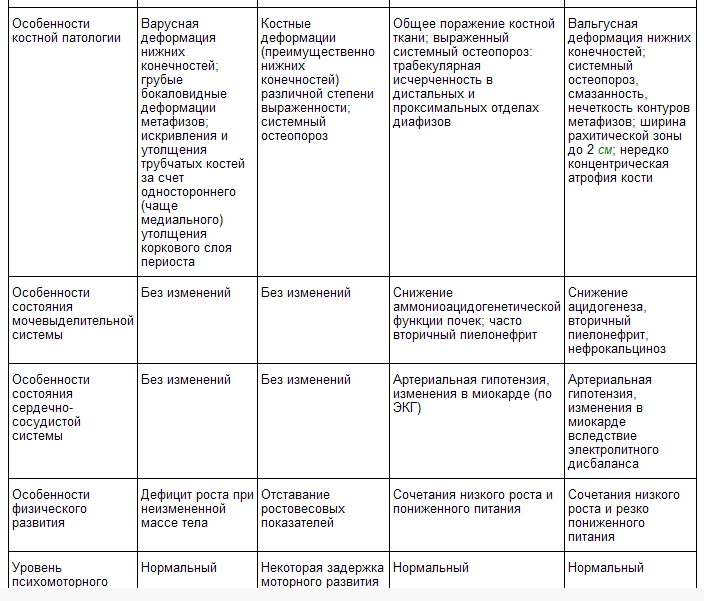
Основными критериями диагностики витамин-D-резистентного рахита служат: клинические проявления — варусный тип и прогрессирующий характер костных деформаций нижних конечностей с отставанием физического развития; доминантный, сцепленный с Х-хромосомой тип наследования патологии; биохимические отклонения в обмене электролитов — низкий уровень фосфора в сыворотке крови, гиперфосфатурия, нормальные показатели общего кальция в крови (2,3—2,75 ммоль/л), повышение активности щелочной фосфатазы крови, повышение уровня паратгормона в крови, снижение абсорбции кальция и фосфора в кишечнике (см. Мальабсорбции синдром); результаты рентгенологического исследования, при котором выявляют два типа костных изменений: либо изменения эпифизов костей с расширением зон пролиферации хряща, грубоволокнистую структуру кости с признаками остеоидной гиперплазии (полная аналогия с рахитом), либо поражение метафизов уже сформировавшейся кости и проявления остеомаляции. Гистологически в костной ткани обнаруживают нарушение структуры костных каналов и трабекул, пролиферацию хряща, чередование усиленного образования остеоидной ткани с участками остеопороза.
Дифференциальный диагноз витамин-D-резистентного рахита и других Р. б. представлен в таблице. Кроме того, дифференциальный диагноз проводят с рядом заболеваний наследственного и приобретенного характера — болезнью Бланта (при которой основным признаком является нарастающая варусная деформация большеберцовой кости как при отсутствии изменений в других отделах костно-суставной системы, так и метаболических расстройств с системными остеодисплазиями — фиброзной остеодисплазией, остеогенезом несовершенным, мраморной болезнью, Педжета болезнью и др. Лечение витамин-D-резистентного рахита как и других Р. б., должно быть комплексным. Оно направлено на коррекцию метаболических расстройств, профилактику осложнений и предупреждение инвалидизации ребенка. Показаниями для лекарственной терапии служат: активный процесс в костной ткани (по ренгенологическим данным), повышение активности щелочной фосфатазы крови, повышенная экскреция фосфатов с мочой, подготовка больных к хирургической коррекции. Основными препаратами в терапии витамин-D-резистентного рахита являются витамин и его метаболиты. Начальные дозы витамина D составляют 10 000 — 15 000 ЕД в сутки. Их увеличивают под контролем показателей кальция и фосфора в сыворотке крови и моче, активности щелочной фосфатазы крови, исследования уровня которых должно проводиться каждые 10—14 дней. Максимальные суточные дозы витамина D в зависимости от клинико-биохимических вариантов болезни составляют: при первом варианте 85 000—100 000 ЕД, при втором 150 000—200 000 ЕД, при третьем — 200 000—300 000 ЕД. При четвертом варианте болезни назначение витамина D противопоказано. Из метаболитов витамина D используют оксидевит в суточной дозе 0,25—3 мкг, при применении которого необходим особенно строгий контроль за уровнем кальция в крови (определяется 1 раз в 7—10 дней). В амбулаторных условиях исследуют мочу на содержание кальция путем постановки реакции Сульковича. Противопоказаниями для консервативной терапии витамином D и его метаболитами являются индивидуальная непереносимость препаратов, выраженная гиперкальциурия (более 4 ммоль/сут.), отсутствие активного процесса в костной ткани по данным лабораторных и рентгенологических исследований. В комплекс лечения витамин-D-резистентного рахита включают препараты кальция: глюконат кальция или хлорид кальция по 1,5—2 г в сутки) и фосфора (фитин 1—1,5 г в сутки, глицерофосфат кальция 0,5—1 г в сутки). Для улучшения процессов всасывания кальция и фосфора в кишечнике рекомендуют длительное (5—6 мес.) применение концентрированных цитратных смесей (например, лимонная кислота 24 г, цитрат натрия 48 г и дистиллированная вода 500 мл) по 20—50 мл в сутки. В активной фазе болезни при наличии болей в костях и суставах показан постельный режим продолжительностью до 2 нед. В период клинико-лабораторной ремиссии и наблюдения больных в амбулаторных условиях ограничивают физические нагрузки, занятия физическими упражнениями и лечебный массаж проводят по специальной щадящей программе, назначают соляно-хвойные ванны, осуществляют санаторно-курортное лечение.
Показателями эффективности консервативной терапии являются улучшение общего состояния больных, увеличение темпов роста детей, нормализация или значительное улучшение показателей фосфорно-кальциевого обмена, снижение активности щелочной фосфатазы крови и положительная динамика структурных изменений костной ткани (по данным рентгенологического исследования).
Хирургическое лечение витамин-D-резистентного рахита сводится к корригирующим остеотомиям костей голеней или бедренных костей с последующей иммобилизацией повязкой или дистракционно-компрессионным аппаратом. Обязательным условием для проведения хирургического лечения служит достижение стойкой клинико-биохимической ремиссии в течение не менее 2 лет.
Витамин-D-зависимый рахит (псевдовитамин-D-дефицитный рахит псевдорахит) является энзимопатией, которая связана с дефектом фермента 1-альфа-гидроксилазы в почках, осуществляющего превращение 25-оксихолекальциферола в 1,25-диоксихолекальциферол. Имеет аутосомно-рецессивный тип наследования, однако встречаются и спорадические случаи заболевания, обусловленные, видимо, свежими первичными мутациями.
Патогенез витамин-D-зависимого рахита можно представить следующим образом: дефицит 1-альфа-гидроксилазы почек ® недостаточный синтез 1,25-диоксихолекальциферола ® снижение абсорбции кальция в кишечнике ® гипокальциемия ® вторичный гиперпаратиреоз ® нарушение фосфорно-кальциевого обмена ® развитие рахитоподобных изменений скелета.
Клинически патология выявляется чаще всего в первые 3—5 мес. жизни ребенка (реже болезнь начинается в 3—5-летнем возрасте). В начальных стадиях характеризуется функциональными изменениями ц.н.с. и вегетативной нервной системы (потливость, нарушение сна, вздрагивания и др.), к которым позднее присоединяются костные поражения. Последние отличаются прогредиентностью, несмотря на ранее проведенную профилактику рахита или проводимое обычное антирахитическое лечение. В зависимости от глубины метаболических расстройств выделяют два клинико-биохимических варианта витамин-D-зависимого рахита: с тяжелой и умеренной степенью выраженности обменных нарушений и костных деформаций. Для первого варианта болезни характерны серьезные костные изменения (варусные, варусно-саблевидные деформации нижних конечностей, деформации грудной клетки, черепа, предплечий, рахитические «четки», «браслетки»; рис. 2), выраженная гипокальциемия (1,4—1,7 ммоль/л), высокие показатели активности щелочной фосфатазы крови, нормальный или слегка сниженный уровень фосфатов в крови, повышенная экскреция фосфатов и значительное уменьшение выделения кальция с мочой, генерализованная гипераминоацидурия. Рентгенологически определяют глубокие нарушения структуры костной ткани (генерализованный остеопороз, широкая рахитическая зона, неровность контуров метафизов и др.). Второму варианту свойственны легкие или умеренные деформации костей преимущественно нижних конечностей с негрубыми структурными изменениями костной ткани по рентгенологическим данным, умеренная гипокальциемия (1,9—2,2 ммоль/л). Развитие первого варианта патологии связывают с выраженным дефицитом 1,25-диоксихолекальциферола, второго — со снижением чувствительности органов-мишеней к этому метаболиту витамина D.
Основными критериями диагностики служат клинические проявления, семейный характер заболевания с аутосомно-рецессивным типом наследования, отмеченные особенности метаболических сдвигов и отсутствие эффекта от проводимого антирахитического лечения витаминов D. Наибольшие дифференциально-диагностические затруднения возникают при разграничении витамин-D-зависимого и витамин-D-дефицитного рахита. В пользу первого свидетельствуют прогрессирующий характер костных деформаций и отсутствие признаков нормализации клинико-биохимических показателей при контрольном лечении витамином D в дозе 4 000 ЕД в сутки в течение 6—8 нед., а также низкий уровень кальция и нормальное содержание 25-оксихолекальциферола в крови.
Особенностью лечения витамин-D зависимого рахита является необходимость заместительной терапии оксидевитом — аналогом биологически активного метаболита витамина D 1,25-диоксихолекальциферола, суточные дозы которого составляют 0,5—4 мкг в зависимости от индивидуальной переносимости препарата и тяжести течения заболевания. Используют также витамин D в дозах от 10 000—15 000 ЕД до 40 000—60 000 ЕД в сутки. В комплекс лечебных средств обязательно рекомендуют включать препараты кальция и фосфора, витамина А, С, Е, цитратные смеси курсами по 3—5 мес. Положительная динамика показателей фосфорно-кальциевого гомеостаза наблюдается обычно через 4—6 нед. после начала комплексной терапии. После отмены препаратов витамина D может развиться (чаще через 3—6 мес.) рецидив заболевания, поэтому лечение следует проводить непрерывно в течение нескольких лет. При рано назначенной и адекватной терапии клинико-биохимические признаки болезни у детей раннего возраста подвергаются обратному развитию. В случаях поздней диагностики, когда уже имеются тяжелые и грубые деформации нижних конечностей, затрудняющие передвижение больных, показана корригирующая остеотомия, условием успешного проведения которой является стойкая клинико-биохимическая ремиссия в течение 11/2—-2 лет.
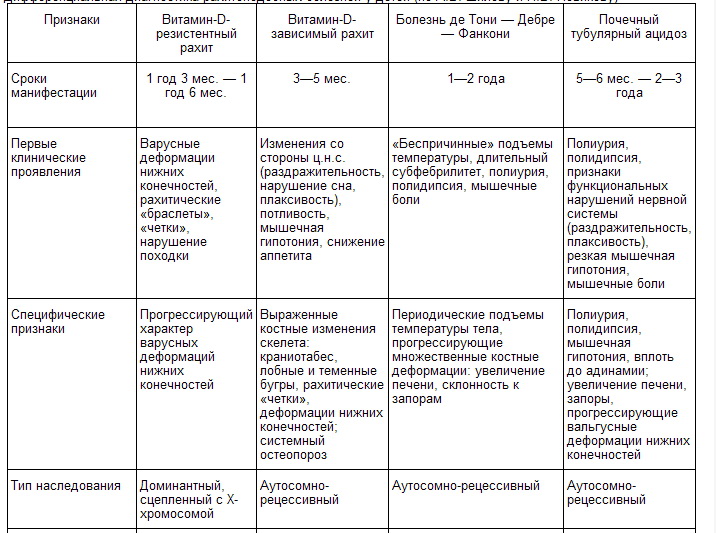
Болезнь де Тони — Дебре — Фанкони (глюкоаминофосфат-диабет) представляет собой наиболее тяжелое заболевание среди Р. б. Наследуется по аутосомно-рецессивному типу, однако экспрессивность мутантного гена в гомозиготном состоянии значительно варьирует; встречаются спорадические случаи, обусловленные свежей мутацией.
Полагают, что в основе болезни лежат генетически обусловленные дефекты ферментативного фосфорилирования в почечных канальцах (комбинированная тубулопатия). Это приводит к нарушению процессов энергообеспечения транспорта фосфатов, глюкозы и аминокислот в почечных канальцах и повышенной их экскреции с мочой, а также расстройству механизмов поддержания равновесия кислот и оснований. Развивающийся метаболический ацидоз и недостаток фосфорных соединений способствуют нарушению формирования костной ткани по типу остеомаляции и рахитоподобных изменений скелета. В ряде случаев выявляют морфологические изменения в почечных канальцах, нарушение функции паращитовидных желез, расстройства синтеза 1,25-диоксихолекальциферола.
В большинстве случаев первые признаки заболевания появляются во второй половине первого года жизни, развернутый симптомокомплекс формируется ко второму году жизни; реже наблюдается поздняя манифестация болезни — в 6—7-летнем возрасте. Начальные клинические проявления — повышенная жажда, полиурия, иногда длительный субфебрилитет, рвота. На втором году жизни выявляют отставание физического развития и костные деформации нижних конечностей (вальгусные или варусные), грудной клетки, предплечий и плечевых костей (рис. 3). Рентгенологически при этом определяют остеопороз системный различной степени выраженности, истончение коркового слоя трубчатых костей, разрыхление зон роста, отставание темпов роста костной ткани от биологического возраста ребенка.
Характерными особенностями биохимических нарушений при болезни де Тони — Дебре — Фанкони являются снижение уровня кальция и фосфора в крови, повышение активности щелочной фосфатазы, метаболический ацидоз (рН — 7,35—7,25; ВЕ = —10—12 ммоль/л). Экскреция кальция с мочой обычно остается нормальной при повышенном клиренсе фосфатов мочи. Отмечают глюкозурию (20—30 г/л и выше), генерализованную гипераминоацидурию и нарушение функций аммониоацидогенеза — снижение титрационной кислотности, повышение рН мочи > 6,0. При полиурии до 2 л и более в сутки удельная плотность мочи, как правило, высокая (1025—1035), что обычно связано с глюкозурией.
В зависимости от тяжести клинических проявлений и метаболических расстройств выделяют два клинико-биохимических варианта болезни де Тони — Дебре — Фанкони. Первый характеризуется значительной задержкой физического развития, тяжелым течением заболевания с выраженными костными деформациями и нередко переломами костей, резкой гипокальциемией (1,6—1,8 ммоль/л), снижением абсорбции кальция в кишечнике. При втором варианте отмечают умеренную задержку физического развития, легкое течение с незначительными костными деформациями, нормокальциемию и нормальное усвоение кальция в кишечнике.
Критериями диагностики являются выраженный дефицит массы тела и роста ребенка, задержка становления статико-моторных функций, рахитоподобные деформации скелета с характерной рентгенологической картиной нарушений структуры костной ткани, отмеченные особенности электролитных нарушений.
Дифференциальный диагноз проводят с рахитом, остеопатиями вследствие хронической почечной недостаточности (см. Остеопатия нефрогенная); кроме того, большое значение имеет дифференцирование первичной болезни де Тони — Дебре — Фанкони с вторичным синдромом, обнаруживаемым при других наследственных и приобретенных заболеваниях (синдроме Лоу, ювенильном нефронофтизе, цистинозе, тирозинемии, галактоземии, гликогенозах, наследственной непереносимости фруктозы, гепатоцеребральной дистрофии, миеломной болезни, амилоидозе, синдроме Шегрена, нефротическом синдроме, при почечной трансплантации, гиперпаратиреозе, поражении почек солями тяжелых металлов, отравлении лекарственными веществами, в т. ч. витамином D, лизолом и т.д.). Синдром Лоу (окулоцереброренальный синдром) в отличие от болезни де Тони — Дебре — Фанкони характеризуется отставанием в умственном развитии, двусторонней катарактой, глаукомой, гипорефлексией, а также рецессивным, связанным с полом типом наследования. Ювенильный нефронофтиз Фанкони, морфологической основой которого являются кисты в мозговом веществе почек на уровне собирательных трубочек и гиалиноз почечных клубочков, отличается ранним нарушением концентрационной функции почек (гипостенурией), нормохромной анемией, гиперазотемией; рахитоподобные изменения скелета присоединяются позже. Решающую роль в диагностике нефронофтиза Фанкони играет исследование биоптата почечной ткани.
Основные принципы лечения заключаются в коррекции электролитных нарушений, сдвигов в кислотно-щелочном равновесии, устранении дефицита калия и бикарбонатов. Особенности применения витамина D и его метаболитов для ликвидации нарушений фосфорно-кальциевого гомеостаза сводятся к необходимости проведения лечения повторными курсами (начальная суточная доза витамина D 25 000—30 000 ЕД, максимальная — 75 000—150 000 ЕД, доза оксидевита 0,5—1,5 мкг в сутки), т.к. при отмене препаратов часто наблюдаются рецидивы (так называемые метаболические кризы, прогрессирование остеопороза и рахитоподобных изменений костной ткани). В комплекс лечения включают препараты кальция, фосфора, витамины А, С, Е, группы В в возрастных дозах. Показано ограничение поваренной соли и включение в рацион продуктов, оказывающих ощелачивающее действие, а также богатых калием. В фазе ремиссии назначают массаж, соляно-хвойные ванны. Хирургическая коррекция при болезни де Тони — Дебре — Фанкони целесообразна только при развитии тяжелых костных деформаций и достижении стойкой клинико-биохимической ремиссии в течение 2 лет.
Почечный тубулярный ацидоз в широком понимании — клинический синдром, характеризующийся постоянным метаболическим ацидозом, низким уровнем бикарбонатов и увеличенной концентрацией хлора в сыворотке крови. У большинства больных постоянно выявляется гипокалиемия из-за потери калия с мочой, сопровождающаяся мышечной слабостью вплоть до параличей; частыми проявлениями патологии служат остеомаляция, нефрокальциноз и мочекаменная болезнь, которые связаны с сопутствующими нарушениями фосфорно-кальциевого обмена. Как синдром почечный тубулярный ацидоз развивается при многих заболеваниях и состояниях, таких как пиелонефрит, интерстициальный нефрит с папиллитом, хроническая почечная недостаточность, нефрокальциноз различного происхождения, гипервитаминоз D, иммунные заболевания почек, гликогенозы, синдром Лоу, отравления солями тяжелых металлов и др.
Почечный тубулярный ацидоз рассматривается и как самостоятельная нозологическая форма, наследственное заболевание, называемое болезнью Лайтвуда — Баттлера — Олбрайта (синдром Лайтвуда — Олбрайта). Первый («классический») тип болезни обусловлен дефектом ацидогенетической функции дистальных почечных канальцев; второй тип зависит от дефекта проксимальных канальцев, не способных реабсорбировать бикарбонаты при сохранности ацидогенетической функции дистальных канальцев. Почечный тубулярный ацидоз наследуется по аутосомно-рецессивному типу, но не исключаются аутосомно-доминантное наследование и спорадические случаи, обусловленные первичными мутациями.
Первые признаки болезни появляются на первом году жизни: отмечаются снижение аппетита, полиурия, полидипсия, быстрая утомляемость. Дети начинают рано отставать в физическом развитии. На втором году жизни развиваются деформации скелета (вальгусные деформации нижних конечностей, «четки», «браслеты», лобные и теменные бугры), выраженная мышечная гипотония. К 2 годам формируется полный симптомокомплекс почечного тубулярного ацидоза. Иногда наблюдается поздняя манифестация (в 5—6-летнем возрасте) в виде прогрессирующих деформаций нижних конечностей (рис. 1, б) и нарушение походки. Рентгенологические изменения костной ткани не имеют специфических особенностей и напоминают таковые при болезни де Тони — Дебре — Фанкони.
Почечному тубулярному ацидозу свойственны следующие биохимические нарушения: метаболический ацидоз (рН — 7,35—7,25, дефицит ВЕ = —10—20 ммоль/л), гипофосфатемия, гипокальциемия, повышение активности щелочной фосфатазы, низкий уровень экскреции титруемых кислот с мочой и повышенный до 7,1 рН мочи, значительное снижение концентрационной функции почек (относительная плотность мочи 1001—1008). В ряде случаев наблюдаются умеренные протеинурия и лейкоцитурия. При рентгенологическом и ультразвуковом исследовании мочевой системы примерно у половины больных выявляют множественные конкременты, расположенные не только в собирательной системе, но и в паренхиме почек (нефролитиаз и нефрокальциноз).
В зависимости от тяжести течения заболевания и глубины метаболических расстройств выделяют два клинико-биохимических варианта почечного тубулярного ацидоза, патогенетически отличающиеся степенью нарушения абсорбции кальция в кишечнике. При первом варианте наблюдаются значительная задержка физического развития, тяжелое течение заболевания с выраженными костными деформациями, гипокальциемия, гипокалиемия, значительный вторичный гиперпаратиреоидизм, сниженное усвоение кальция в кишечнике. Второй вариант характеризуется умеренной задержкой физического развития, относительно легким течением заболевания с незначительными костными деформациями, нормокальциемией и нормокалиемией, а также нормальным усвоением кальция в кишечнике.
Основными критериями диагностики почечного тубулярного ацидоза являются: раннее начало заболевания, задержка физическое развития, вальгусные деформации нижних конечностей, выраженный метаболический ацидоз, высокий рН мочи, гиперкальциурия, нефрокальциноз.
Дифференциальный диагноз проводят с заболеваниями, при которых почечный тубулярный ацидоз может быть лишь симптомом основной патологии. В этом случае диагностика базируется на учете признаков ведущего заболевания.
Особенностью лечения почечного тубулярного ацидоза является направленность на коррекцию метаболического ацидоза, гипокалиемии с помощью бикарбоната натрия, препаратов калия, цитратных смесей, димефосфона. При явлениях остеопороза и остеомаляции показано назначение препаратов витамина D или его метаболитов (начальные суточные дозы витамина D 10 000—20 000 ЕД, максимальные — 30 000—60 000 ЕД; суточные дозы оксидевита 0,5—2 мкг), препаратов кальция до нормализации его уровня в крови. При оксалатно-кальциевом нефролитиазе рекомендуют окись магния по 0,2—0,25 г в сутки курсами по 3—4 нед. в течение длительного времени, 15% раствор димефосфона в суточной дозе 1 мл на 5 кг массы тела, а также исключение из рациона продуктов, богатых оксалатами (щавель, шпинат, томатный сок, шоколад и др.). Лекарственную терапию проводят на фоне общеукрепляющего лечения с включением щелочных минеральных вод, фруктовых соков, ограничении белков животного происхождения, использованием комплекса витаминов (А, Е, группы В).
Под влиянием комплексного лечения у больных улучшаются общее состояние, показатели фосфорно-кальциевого обмена, активность щелочной фосфатазы крови, определяется положительная динамика рентгенологической картины структурных изменений костной ткани, особый контроль проводят за показателями кислотно-основного состояния (дефицит ВЕ), рН мочи, уровнем кальция и фосфора в крови, определение которых должно осуществляться 1 раз в 7—10 дней.
Хирургическое лечение рекомендуют только детям с выраженными костными деформациями нижних конечностей, которые затрудняют их передвижение, при этом необходима двухгодичная стабилизация клинико-биохимических показателей.
Тесты для самоконтроля
1. Девочка 6 лет поступила с жалобами на повышение температуры тела до 37,20С, частые и болезненные мочеиспускания, которые появились после переохлаждения. В общем анализе мочи: моча мутная, удельный вес – 1012,белок 0,033 г/л; микроскопия: лейкоциты 40-45 в п/з, еритроциты 8-9 в п/з (свежие), эпителий плоский: 5-8 в п/з, слизь. Какой этиологический фактор в данном случае наиболее вероятен?
A Стафилокок
B Кишечная палочка
C Клебсиела
D Протей
E Кандиды
2. У девочки 4 лет частые болезненные мочеиспускания, больв надлобковой области. В клиническом анализе мочи – лейкоцитурия, микрогематурия, клетки эпителия мочевого пузыря, острицы. В кале – яйца остриц. Установлен диагноз: острый цистит,энтеробиоз. Назначение какого препарата является необходимым для профилактики развития рецидивирующего цистита в данном случае?
A Диэтилкарбамазин B Трихопол C Празиквантел
D Пирантел E Никлозамид
3. В медицинской амбулатории в сельской местности отсутствует бактериологическая лаборатория. На приеме девочка 13 лет которая жалуется на боль в пояснице, повышение температуры тела до 37,80С. В общем анализе мочи: эритроциты 2–3 в поле зрения, лейкоциты 20–40 в поле зрения. Какое диагностическое значение приведенного анализа у больной?
A Нет диагностического значения
B Указывает на возможную инфекцию мочевых путей
C Подтверждает инфекцию мочевых путей
D Подтверждает постстрептококковый гломерулонефрит
E Указывает на возможный постстрептококковый гломерулонефрит
4. Больной С. 5лет заболел, когда появилась общее недомогание, повысилась температура тела до 37,5°С, голос стал осиплым. Объективно: миндалины увеличены, умеренный цианоз, покрыты налетом серого цвета, налет выходит за пределы миндалин, с трудом снимается, после его удаления слизистая кровоточит. АД 110/70 мм. рт. ст. Отеков нет. В анализе мочи альбуминурия, цилиндрурия, единичные эритроциты. Какой патологический процесс в почках?
A. Нефроз почек. B.Пиелонефрит.
C. Гломерулонефрит. D.Паранефрит. E.Токсический нефрит.
5. У 3-х летнего ребенка, который находился на стационарном лечении по поводу острой внебольничной двусторонней бактериальной пневмонии отмечается быстрое прогрессирование ухудшения состояния. Уровень сознания – кома I ст., адинамия, мышечная гипотония, кожные покровы холодные, бледно-цианотичные. На коже и видимых слизистых оболочках – геморрагии и пятна буро-синего цвета. Дыхание поверхностное, 38 за минуту, аускультативно – жесткое, хрипов нет. Пульс нитевидный, 152 за минуту, артериальное давление - 60/20 мм.рт.ст., симптом „бледого пятна” – 3,5 секунды, темп почасового диуреза – 0,25 мл/кг/час. Не смотря на проводимую инфузию дофамина в кардиопрессорных дозах артериальное давление остается низким. Наиболее вероятной причиной развития данного состояния является:
A. Острая дыхальная недостаточность B. Острая надпочечниковая недостаточность
C. Острая сердечная недостаточность D. Острая почечная недостаточность
E. Острая церебральная недостаточность.
6. Ребенок 7 месяцев. Неделю назад перенес ОРВИ. Физическое и нервно-психическое развитие соответствуют возрасту. Жалобы на вялость, снижение аппетита, немотивированную повторную рвоту, повышение температуры тела в течение последних суток до 38°С, бледность, частое мочеиспускание малыми порциями. ЧСС – 150 в 1 минуту. В общем анализе мочи: белок- 0,099 г/л, лейкоциты - 30-50 в п/зр., бактериурия - +++, слизь - +++. О каком заболевании можно думать?
А. Фосфат-диабет B. Дисметаболическая нефропатия C. Острый гломерулонефрит
D. Острый пиелонефрит E. Дефекты ухода
7. У девочки 14 лет, которая на протяжении последних 3 лет получает преднизолон у дозе 20-40 мг/сут по поводу системной красной волчанки (СКВ), сразу после травмы руки (закрытый перелом локтевой кости в средней трети) появились рвота, слабость. Врач кареты скорой помощи, которая прибыла на место травмы, для предупреждения болевого шока ввел омнопон. Однако, несмотря на значительное снижение болевого синдрома, состояние больной не улучшилось. При физикальном обследовании: девочка заторможена, бледная, кожа чистая, пульс слабого наполнения, тоны сердца глухие, тахикардия, АД 70/40 мм.рт.ст. Какое неотложное состояние развилось у девочки?
A Острая надпочечниковая недостаточность.
B Травматический шок.
C Острая почечная недостаточность.
D Нарушение сознания вследствие СКВ.
E Анафилактический шок на введение омнопона.
8. У девочки 6 лет имеют место дизурические явления. В анализе мочи: лейкоциты – 30-40 в п/з, бактерии и слизь - в значительном количестве. При УЗИ выявлено утолщение стенки мочевого пузыря до 10 мм. Какой лекарственный препарат следут назнчить?
A Левомицетин B Цефадроксил
C Метронидазол D Канамицин
E Пенициллин
9. У ребенка 10 лет наблюдаются подъемы температуры тела до 38,5С, ухудшение самочувствия и аппетита, периорбитальные тени, умеренно выраженная боль в поясничной области справа. Катаральных явлений нет. В общем анализе крови лейкоциты - 14 ·109/л, палочкоядерные нейтрофилы - 12 % , сегментоядерные нейтрофилы - 72 %, лимфоциты – 12, моноциты – 4, СОЭ - 35 мм/час. В общем ан. мочи - цвет желтый, мутная, в осадке - хлопья фибрина, лейкоциты - 50-70 в п/зр., выявлены активные лейкоциты, много бактерий. Бактериурия - более 105 в 1 мл мочи. УЗ-исследование почек – повышение эхогенности чашечно-лоханочной системы справа, отек интерстиция. Ваш предварительный диагноз?
А. Острый цистит B. Дистопия правой почки C. Острый пиелонефрит
D. Дисметаболическая нефропатия E. Дисплазия правой почки
10. Девочка 5 лет была госпитализирована с жалобами на генерализованные отеки на лице, передней брюшной стенке, нижних конечностях, уменьшение суточного диуреза до 300 мл, снижение аппетита. А общем анализе мочи : белок-3 г/л, эритроцитф – 1-2, лейкоцитф – 6-7 в поле зрения, удельный вес – 1027. Общий анализ крови - гемоглобин – 110 г/л, лейкоциты – 10 Г/л. Наиболее вероятный диагноз?
A Острый гломерулонефрит с нефритическим синдромом
B Интерстициальный нефрит
C Пиелонефрит
D Поликистоз почек
E Острый гломерулонефрит с нефротическим синдромом
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
В |
D |
B |
E |
D |
D |
A |
B |
C |
E |
Задача 1
Ребенку 6 мес. Девочка доставлена в больницу каретой скорой помощи с жалобами на повышение температуры тела до 38,50 С, приступы беспокойства, снижения аппетита, рвоту, жидкий стул.
Из анамнеза известно, что ребенок родился от ІІ беременности, ІІ физиологических родов на 39 неделе. Мать в І триместре беременности перенесла грипп, токсичную форму. Масса тела при рождении 2.650 г. Находится на искусственном вскармливании. Масса тела в настоящее время – 6 300.
Заболела остро, сначала возникли приступы беспокойства во время мочеиспускания, потом повысилась температура тела до 38,80 С и другие симптомы.
При объективном обследовании состояние ребенка тяжелое. Тяжесть состояния обусловлена выраженными симптомами интоксикации. Ребенок вялый, бледный. Кожа и слизистые оболочки бледные, чистые. Большой родничок запавший, 1,5 см на 1 см. Мышечный тонус и тургор тканей снижены. Обращают на себя внимание стигмы дизэмбриогенеза: аномалия формы черепа, ушных раковин, гипертеларизм, широкая переносица. В легких дыхание пуэрильное, хрипов нет. Тоны сердца ослаблены, ритмичные. ЧСС – 150 за 1 минуту, ЧД – 42 за 1 минуту. Границы относительной сердечной тупости в пределах возрастной нормы. Живот умеренно вздут, во время пальпации живота ребенок беспокоен. Нижний край печени выступает из- под края реберной дуги на 2,5 см. Стул жидкий, желтого цвета, 3 раза в сутки. Мочится достаточно.
В общем анализе крови лейкоциты 25 · 109/л, СОЭ – 47 мм/год. В общем анализе мочи: моча мутная, белок - 0,99 г/л, лейкоциты – покрывают все поле зрения, бактерии ++++.
1. Какой предварительный диагноз можно поставить? Обоснуйте его.
2. Какие методы исследования для подтверждения диагноза нужно назначить этому ребенку?
3. Проведите дифференциальную диагностику.
4. Назначьте лечение.
Задача 2
Родители больного ребенка 4 лет обратились к участковому врачу с жалобами на частые болезненные мочеиспускания, особенно в конце акта, малыми порциями. Накануне вышеуказанных жалоб имело место переохлаждение. Девочке 7 дней назад был поставлен диагноз глистная инвазия.
Заболела остро, когда появились вышеуказанные жалобы. При объективном обследовании состояние ребенка нарушено мало. Активная. Масса тела 17 кг. Кожа чиста, розовая. В легких дыхания везикулярное, хрипов нет. Тоны сердца ритмичные, звучные. ЧСС – 100 за 1 минуту. ЧД – 24 за 1 минуту. Живот – мягкий, отмечается болезненность в надлобковой области. Мочеиспускание: имеют место императивные позывы, до 20 раз в сутки, болезненные, малыми порциями.
Общий анализ крови без патологических изменений. В общем анализе мочи: лейкоциты – 20-40 в поле зрения, эритроциты – 15-20 в поле зрения, свежие, бактерии - ++.
1. Какой предварительный диагноз можно поставить? Обоснуйте его.
2. Какие методы исследования для подтверждения диагноза нужно назначить этому ребенку?
3. Проведите дифференциальную диагностику.
4. Назначьте лечение.
Задача 3
Мальчик 13 лет поступил в детский стационар по поводу обострения вторичного пиелонефрита. После проведения исследования мочи на бактериурию в моче, взятой из средней порции при естественном мочеиспускании, получены следующие данные: выделено Proteus vulgaris, в количестве 300 000 микробных тел в 1 мл, чувствительный к цефатоксиму, цефтазидиму. При проведении микционной цистографии выявлен пузырно-мочеточникоыф рефлюкс II стенпени.
Назначьте лечение данному больному и схему диспансерного наблюдения (масса тела – 50 кг)
Задача 4
Девочке 4 лет, при оформлении в ДДУ был назначен общий анализ мочи. Получены следующие данные:
Показатель |
Результат |
Количество |
70,0 |
Цвет |
соломенно-желтый |
Прозрачность |
Мутная |
Удельный вес |
1025 |
Реакция (рН) |
Щелочная |
Белок (г/л) |
0,066 |
Глюкоза (ммоль/л) |
- |
Кетоновые тела |
- |
Реакция на кровь |
- |
Билирубин |
- |
Уробилиновые тела |
- |
Желчные кислоты |
- |
Микроскопическое исследование |
|
Эритроциты |
0-1 в п/з |
Лейкоциты |
50-70 в поле зрения |
Эпителий: плоский |
В значительном количестве |
переходный |
- |
почечный |
- |
Цилиндры: |
- |
Гиалиновые |
- |
Зернистые |
- |
Эпителиальные |
- |
Эритроцитарные |
- |
Лейкоцитарные |
- |
Восковидные |
- |
Фибрин |
- |
Слизь (гомогенная, волокнистая, уретральная_ |
В значительном количестве |
Соли |
- |
Бактерии |
++++ |
Конкретных жалоб у родителей нет, за исключением того, что 1 месяц назад у ребенка имела место глистная инвазия, получала противоглистные препараты. При детальном расспросе, мать отмечает, что иногда по вечерам у ребенка отмечается признаки вялости, усталость. Масса тела 20 кг
После проведения исследования мочи на бактериурию в моче, взятой из средней порции при естественном мочеиспускании, получены следующие данные: выделена Е.coli, в количестве 100 000 микробных тел в 1 мл, чувствительная к цефатоксиму, цефтазидиму.
1. Какой предварительный диагноз можно поставить? Обоснуйте его.
2. Какие методы исследования для подтверждения диагноза нужно назначить этому ребенку?
3. Проведите дифференциальную диагностику.
4. Назначьте лечение.
Задача 5
Родители мальчика 7 лет обратились с жалобами на частые болезненные мочеиспускания небольшими порциями до 20- раз в сутки.
При детальном расспросе установлено, что вышеуказанные жалобы появились 2 недели назад и связаны с походом ребенка в 1 класс, причем частые мочеиспускания отмечаются утром перед школой и в школе. Во второй половине дня мочеиспускания урежаются. Кроме этого у ребенка имели место респираторные тики и энурез.
При объективном обследовании состояние ребенка относительно удовлетворительное. Выражено волнение при осмотре. Кожа чиста, розовая, ладони влажные наощупь. В легких дыхания везикулярное, хрипов нет. Тоны сердца ритмичные, звучные. ЧСС – 94 за 1 минуту. ЧД – 20 за 1 минуту. Живот – мягкий, безболезненный при пальпации. Мочеиспускание: имеют место императивные позывы, до 20 - 25 раз в сутки, безболезненные, малыми порциями.
1. Какой предварительный диагноз можно поставить? Обоснуйте его.
2. Какие методы исследования для подтверждения диагноза нужно назначить этому ребенку?
3. Проведите дифференциальную диагностику.
4. Назначьте лечение.
|
Ответы на задачи |
1 |
Острый пиелонфрит, активная стадия. Посев мочи на бактериурию и чувствительность к антибиотикам. Инфузионная терапия – глюкозо-солевые растворы, реосорбилакт в/в 8–10 мл на 1 кг массы тела, в/в капельно 1 раз день; на курс лечения — 3-5 инфузий) С жаропонижающей целью – парацетамол (15 мг/кг - разовая доза).Цефотаксим 200 тыс х 3 раза в/в 7 дней, после нормализации температуры тела, улучшения самочуствия, уменьшения симптомов интоксикации – перейти на пероральный цефалоспорин III поколения – цефикс 8 мг/кг (50 мг ) в 5 мл – 100 мг: по1,25 мл 2 раза 7 дней. Дальнейшее лечение - поддерживающая доза уроантисептика |
2 |
Инфекция мочевыводящих путей, возможно острый цистит. Глистная инвазия. Посев мочи на батериурию и чувствительность к антибиотикам. Фурамаг 10 мг/кг: по 85 мг 2 раза 5 дней |
3 |
Цефотаксим 1,0 х 3 раза в день в/в 7 дней затем цефикс по 200 мг х 2 раза в день, 7 дней. Затем уроантисептик - 1/3-1/4 от терапевтической дозы 2 года (фурамаг 50 мг 1 таблетка в сутки). Контроль анализов мочи ежемесячно. Диспансерное наблюдение: Функциональные пробы при пиелонефрите ежегодно (проба Зимницкого), уровень креатинина. Посев мочи — необходимо исследовать через 6 недель после окончания лечения для того, чтобы убедиться, что моча стерильна. Учитывая тенденцию ИМС к рецидивированию, целесообразно данное исследование производить вначале ежемесячно, а затем с 3-месячным интервалом в течение 1-2 лет, даже если у ребенка нет никаких симптомов. Измерение артериального давления регулярно. При пузырно-мочеточниковом рефлюксе — цистография и нефросцинтиграфия 1 раз в 1–2 года. Санация очагов инфекции, профилактика запоров, коррекция дисбактериоза кишечника, регулярное опорожнение мочевого пузыря. |
4 |
Инфекция мочевыводящих путей. Цефиксим по 80 мг х 2 раза в день 5 дней. |
5 |
Нейрогенный мочевой пузырь. Общий анализ мочи, анализ мочи по Нечипоренко. Посев мочи на стерильность и чувствительность к антибиотикам. УЗИ почек и мочевыводящих путей. При отсутствии изменений со стороны анализов мочи – лечение неврозоподобного состояния. |
Литература
В. Г. Майданник. Педиатрия: Учебник для студентов высших мед. учеб. заведений III—IV уровней аккредитации. 2-е изд
Н.П. Шабалов. Детские болезни: Учебник ю 5-е издание В двух томах- СПб: Питер, 2002.
М.С.Игнатов,Ю.Е.Вельтищев «Детская нефрология»
А.П. Волосовец, С.П. Кривопустов «Антимикробная терапия инфекций мочевой системы у детей.
European Association of Urology 2008
Guidelines on The Management of Urinary and Male Genital, Tract Infections
M. Grabe (Chairman), M.C. Bishop, T.E. Bjerklund-Johansen,
H. Botto, M. Çek, B. Lobel, K.G. Naber, J. Palou, P. Tenke
