
Министерство высшего образования Российской Федерации
Новосибирский национальный исследовательский государственный университет
Курсовая работа по дисциплине:
«Аналитическая химия»
на тему:
«Комплексонометрическое определение алюминия»
Выполнил
Студент ФЕН
2 курса группы 12401
Печуров В.К.
Преподаватель:
Демидова М.Г.
Новосибирск 2013 г.
Содержание
стр
Введение…………………………………………………………………...3
Теоретическая часть….……………………………………………...........4
Практическая часть………..…………………………………………. …..8
Результаты и их обсуждение……………………………………………..10
Выводы…………………………………………………………………….10
Литературный обзор……………………………………………………...11
Список литературы……………………………………………………….13
Введение
Комплексонометрические методы титрования обладают высокой точностью, приближающейся к точности гравиметрических методов, и в то же время требуют значительно меньше времени для выполнения, чем последние. Благодаря этому комплексонометрические методы нашли широкое применение при определении алюминия в различных материалах.
Как трехвалентный металл с координационным числом 6, алюминий валентными связями присоединяется к карбонильным группам и координационно связывается с аминогруппами и с молекулой воды. Такие комплексы преобладают в слабокислой среде. При pH > 8 преобладают комплексонаты типа [Al(OH)(H2O)Y]2- и [Al(OH)2Y]3-.
Комплексонат алюминия - довольно прочный комплекс. Однако, несмотря на это, процесс его образования протекает довольно медленно. Это объясняется склонностью алюминия к образованию гидратированного иона [Al(H2O)6]3+. Вследствие плотной упаковки молекул воды внутренней сферы гексааквоалюминиевого комплекса обменная реакция между ними и комплексоном III очень мала. При нагревании до кипения эта обменная реакция протекает быстро.
Теоретическая часть
Приготовление раствора хлорида цинка
Рассчитываем навеску цинка необходимую для приготовления приблизительно 0.045N раствора хлорида цинка:
m=NV(р-ра)Mr(Zn)=0.045*0.5*65.38=1.471 г
Масса цинка полученная при взвешивании: 1.4485 г
Следовательно точная концентрация хлорида цинка:
N=m(Zn)/ V(р-ра)Mr(Zn)=1.4485/(0.5*65.38)=0.04431 моль экв./л
Определение алюминия методами обратного титрования и замещения
Стандартизация ЭДТА по цинку с ксиленоловым оранжевым
Рассчитываем нормальную концентрацию раствора ЭДТА из 4 сходящихся результатов:
N(ЭДТА)=N(Zn2+)V(Zn2+) /V(ЭДТА)
Определение алюминия с ксиленоловым оранжевым
Рассчитываем нормальную концентрацию алюминия из 5 сходящихся результатов:
N(Al3+) =(N(ЭДТА)V(ЭДТА)-N(Zn2+)V(Zn2+))/V(Al3+)
N1= 0.03017 моль экв./литр
N2= 0.03027 моль экв./литр
N3= 0.03032 моль экв./литр
N4= 0.03017 моль экв./литр
N5= 0.03023 моль экв./литр
m(Al3+)=N(Al3+)Mr(Al3+)V(колбы)
m1(Al3+)=0.2035 г
m2(Al3+)=0.2042 г
m3(Al3+)=0.2045 г
m4(Al3+)=0.2035 г
m5(Al3+)=0.2039 г
m(Al3+)средняя=0.2039 г
Рассчитываем нормальную концентрацию алюминия по титрованию после замещения:
Нормальная концентрация ЭДТА равна нормальной концентрации алюминия после замещения.
N(Al3+)= N(Zn2+)V(Zn2+)/ V(аликвоты)
N1= 0.03035 моль экв./литр
N2= 0.03035 моль экв./литр
N3= 0.03031 моль экв./литр
N4= 0.03035 моль экв./литр
N5= 0.03035 моль экв./литр
m(Al3+)=N(Al3+)Mr(Al3+)V(колбы)
m1(Al3+)=0.2047 г
m2(Al3+)=0.2047 г
m3(Al3+)=0.2045 г
m4(Al3+)=0.2047 г
m5(Al3+)=0.2047 г
m(Al3+)средняя=0.2047 г
Статистический обсчет результатов титрования
Статистический
обсчет титорвания алюминия с ксиленоловым
оранжевым :
1. Стандартное отклонение единичного
измерения:
s
=
 =
=

2.
Стандартное отклонение средней величины:

3.
Относительное стандартное отклонение:
 = 0,002 (0,2%)
= 0,002 (0,2%)
Статистический
обсчет результатов титрования после
замещения :
1. Стандартное отклонение единичного
измерения:
s
=
 =
=

2.
Стандартное отклонение средней величины:


3. Относительное стандартное отклонение: = 0,0005 (0,05%)
Сравнение средних двух выборок:
F=
 =
=
 = 4.4
< F(0,95;f1;f2)
= 6,39
,
= 4.4
< F(0,95;f1;f2)
= 6,39
,
f1 = n1 – 1 = 4,
f2 = n2 – 1 = 4,
Выборочные
дисперсии различаются незначительно,
следовательно, выборочные средние можно
сравнить при помощи критерия Стьюдента:
 *
* ,
(*)
,
(*)
f = n1 + n2 – 2 = 8.
Pдов. = 0,95.
 = 0.2047 –0.2039 = 0.0008.
= 0.2047 –0.2039 = 0.0008.
 *
= 2,31
*
= 2,31 *
* = 0,02%.
Неравенство
(*)
выполняется, следовательно, результаты
двух выборок можно объединить.
Объединение
результатов двух выборок:
= 0,02%.
Неравенство
(*)
выполняется, следовательно, результаты
двух выборок можно объединить.
Объединение
результатов двух выборок:
m1(Al3+)=0.2035 г
m2(Al3+)=0.2042 г
m3(Al3+)=0.2045 г
m4(Al3+)=0.2035 г
m5(Al3+)=0.2039 г
m6(Al3+)=0.2047 г
m7(Al3+)=0.2047 г
m8(Al3+)=0.2045 г
m9(Al3+)=0.2047 г
m10(Al3+)=0.2047 г
m(Al3+)средняя=0.2043 г
Стандартное отклонение единичного измерения: s =
 =
=

Расчет доверительного интервала:
Δ
=
 =
=
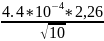 = 0.0003 г
= 0.0003 г
Таким образом, конечным результатом определения содержания
алюминия является значение
m = 0.2043±0,0003 г.
