
Окислительно-восстановительное титрование
Окислительно-восстановительные взаимодействия связаны с переносом электронов между реагирующими частицами – молекулами, ионами или комплексами. Окислением называется реакция, связанная с потерей электрона реагирующей частицей, восстановлением – реакция, связанная с приобретением электронов. Частицу, отдающую электрон, называют восстановителем, а принимающую электроны – окислителем. Молярное отношение между окисляющимся веществом и восстанавливающимся веществом должно быть таково, что число электронов, отданных одним веществом, равно числу электронов, принятых другим. Это следует учитывать при составлении окислительно-восстановительных реакций. Любую реакцию можно представить, как сумму полуреакций.
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
 5 Fe2+
- e
→ Fe3+
5 Fe2+
- e
→ Fe3+
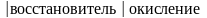
1
MnO4-
+ 5e
+ 8H+
→ Mn2+
+ 4H2O

Мерой движущей силы полуреакции является электродный потенциал окислительно-восстановительной системы, который определяется как ЭДС гальванического элемента, составленного из исследуемой ОВ – системы в паре со стандартным водородным электродом, потенциал которого принят за 0,00 В при любой температуре.
Например:
(+) Cu | Cu2+ || H+ | H2 (Pt) (–) Cu2+ + 2е Cu0 H2 – 2е 2H+
(–) Zn | Zn 2+ || H+ | H2 (Pt) (+) Zn 0– 2е Zn 2+
2H+ + 2е H2
Под равновесным электродным потенциалом понимают потенциал, устанавливающийся на металлическом электроде в растворе своей соли (на инертном электроде, погруженном в раствор, содержащий ОВ – систему) в отсутствие электрического тока.
Стандартный
электродный потенциал Е0
– это равновесный потенциал, который
данная окислительно-восстановительная
система имеет в том случае, когда все
компоненты, участвующие в полуреакции,
находятся в стандартном состоянии, т.е.
их активности равны единице (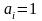 ).
Мы будем считать, что состояние иона
близко к стандартному, если его
концентрация составляет 1 моль/дм3.
(Потенциалы,
измеренные в паре со стандартным
водородным электродом при активности
ионов равной 1 и температуре 25°С,
называются стандартными электродными
потенциалами и обозначаются
).
Мы будем считать, что состояние иона
близко к стандартному, если его
концентрация составляет 1 моль/дм3.
(Потенциалы,
измеренные в паре со стандартным
водородным электродом при активности
ионов равной 1 и температуре 25°С,
называются стандартными электродными
потенциалами и обозначаются
 ,
,
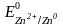 (
прил. 6).
(
прил. 6).
По соглашению Международного союза по теоретической и прикладной химии (IUPAC) термин «электродный потенциал» относится исключительно к полуреакциям, записанным в форме реакции восстановления.
Например:
Cu2+ + 2е Cu0 = + 0,337 В.
Zn 2+ + 2е Zn0 = – 0,76 В.
За знак электродного потенциала принимают действительный знак изучаемого электрода относительно стандартного водородного электрода, который указывает направление самопроизвольного протекания процесса. Так, положительный знак медного электрода означает, что реакция
Cu2+ + Н2 Cu0 + 2Н+
при обычных условиях протекает в сторону выделения металлической меди (слева направо). С другой стороны, отрицательный знак электродного потенциала цинка означает, что аналогичная реакция
Zn 2+ + Н2 Zn0 + 2Н+
самопроизвольно протекает в сторону растворения металлического цинка (справа налево).
Зависимость между величиной электродного потенциала полуреакции и концентрацией потенциалопределяющих ионов (компонентов ОВ – системы) выражается уравнением Нернста.
 (24)
(24)
где Е – потенциал, В;
 – стандартный
электродный потенциал, В;
– стандартный
электродный потенциал, В;
R – газовая постоянная, 8,314 Дж/(моль·К);
Т – абсолютная температура, К (273 + t°С);
n – число электронов, участвующих в реакции;
F – число Фарадея, 96485,3399 0,0024 Кл/моль;
[Ox], [Red] – соответственно равновесные концентрации окисленной и восстановленной форм;
a, b – стехиометрические коэффициенты.
При температуре 25°С и переходе к десятичным логарифмам получаем уравнение в виде
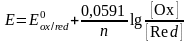 .
(25)
.
(25)
В
процессе титрования происходит изменение
потенциала титруемой системы, так как
постоянно меняется соотношение
 ,
однако после каждой порции добавленного
титранта в растворе устанавливается
состояние равновесия (ЕOx
= ERed
= Eсист).
Наиболее резкое изменение потенциала
происходит вблизи точки эквивалентности.
,
однако после каждой порции добавленного
титранта в растворе устанавливается
состояние равновесия (ЕOx
= ERed
= Eсист).
Наиболее резкое изменение потенциала
происходит вблизи точки эквивалентности.
