
Лекция №14 КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ (АЛЬДЕГИДЫ и КЕТОНЫ)
Карбонильные соединения ― органические соединения, в молекулах которых содержится карбонильная группа (>С=О). Они делятся на две группы - альдегиды и кетоны. Если карбонильная группа соединена с атомом водорода и с углеводородным радикалом, то класс веществ называется альдегидами. Если карбонильная группа соединена с двумя углеводородными радикалами, то класс веществ называется кетоны.
Общая формула представителей альдегидов и кетонов СnН2nО.
Номенклатура альдегидов
Систематическая:
а) выбирают самую длинную цепь содержащую альдегидную группу;
б) нумерацию цепи начинают с той стороны, где ближе расположена альдегидная группа;
в) положение альдегидной группы в названии цифрой не указывается;
г) название альдегида строится от названия алкана, в котором суффикс АН заменяется на АЛЬ.
Пример:
СН3 СН3 │ │ СН3―СН―С―С=О │ │ СН3 Н 2,2,3-триметилбутаналь |
СН2―СН2―С=О │ │ Br Н 3-бромпропаналь |
Тривиальная:
1. Н―СН=О - формальдегид, муравьиный альдегид;
2. СН3―СН=О - уксусный альдегид, ацетальдегид;
3. СН3―СН2―СН=О - пропионовый альдегид;
4. СН3―(СН2)2―СН=О - масляный альдегид;
5. СН3―(СН2)3―СН=О - валериановый альдегид;
6. СН3―(СН2)4―СН=О - капроновый альдегид.
Номенклатура кетонов
Систематическая:
а) выбирают самую длинную цепь содержащую карбонильную группу;
б) нумерацию цепи начинают со стороны карбонильной группы;
в) положение карбонильной группы указывается цифрой перед общим названием кетона;
г) название кетона строится от названия алкана, в котором суффикс АН заменяется на ОН.
СН3 │ СН3―С―С=О │ │ СН3 СН3 3,3-диметил-2-бутанон |
Для кетонов тривиальное название используется для первого представителя – ацетона (СН3СОСН3). Рациональная: названия кетонов строятся путем перечисления радикалов связанных с карбонильной группой в порядке возрастания их молекулярной массы и добавлением основы «кетон». (верхний пример - 3,3-диметил-2-бутанон по рациональной номенклатуре метилтретбутилкетон).
Изомерия карбонильных соединений
Структурная изомерия:
а) изомерия углеродного скелета;
б) положение функциональной группы (только для кетонов, начиная с С5Н10О);
в) межклассовая изомерия (альдегиды являются изомерами для кетонов и наоборот).
Стереоизомерия: геометрическая изомерия у карбонильных соединений отсутствует, оптическая изомерия возможна при наличии хирального атома.
Физические свойства карбонильных соединений
Первый представитель альдегидов (формальдегид) - газ с резким запахом; остальные - жидкости; высшие альдегиды - твердые вещества. Первый представитель кетонов (ацетон) - жидкость. И альдегиды и кетоны достаточно приятно пахнут, за исключением первых представителей. Низшие альдегиды и кетоны - легкокипящие жидкости, хорошо растворимы в воде, из-за возможности образования межмолекулярных водородных связей (у воды есть подвижный атом водорода, у карбонильных соединений атом кислорода, содержащий две неподеленные пары электронов). С увеличением молекулярной массы растворимость в воде карбонильных соединений падает.
Получение карбонильных соединений
Получение альдегидов |
Получение кетонов |
1. Озонолиз алкенов с последующим гидрирование образовавшегося продукта |
|
Н Н │ │ R―С=С―R/ + O3 (H2 кат-р Ni) → R―CH=O + R/―CH=O + Н2О (смесь альдегидов) |
R// R/// R// │ │ │ R―С=С―R/ + O3 (H2 кат-р Ni) → R―C=O + R/―C=O + Н2О │ R/// (смесь кетонов) |
2. Расщепление вицдиолов иодной кислотой HIO4 |
|
OH OH H │ │ │ R―СH―CH―R/ + HIO4 → R―C=O + R/―C=O + НIO3 + H2О │ H (смесь альдегидов) |
R// R/// R// R/// │ │ │ │ R―С―С―R/ + HIO4 → R―C=O + R/―C=O │ │ ОН ОН + Н2О + HIO3 (смесь кетонов) |
3. Гидратация алкинов (реакция Кучерова) в присутствии солей Hg (II) |
|
Из ацетилена - уксусный альдегид СН≡СН + Н2О → СН3―СН=О |
Из гомологов ацетилена - различные кетоны R―С≡СН + Н2О → R―С=О │ CH3 R―С≡С―R/ + Н2О → R―С=О │ CH2―R/ |
4. Взаимодействие геминальных дигалогенпроизводных алканов с водными растворами щелочей |
|
Из первичных дигалогенпроизводных алканов - альдегиды Нal H │ │ R―СН―Hal + 2NaOH → R―C=O + + 2NaHal + H2O |
Из вторичных дигалогенпроизводных алканов - кетоны Нal │ R―С―R/ + 2NaOH → R―C=O + 2NaHal + │ │ + H2O Hal R/ |
5. Пиролиз (термическое разложение) кальциевых и бариевых солей карбоновых кислот |
|
Из смешанных солей муравьиной и других кислот - альдегидов О ║ R―С―О Ca (t0C) → R―СH=О + CaCO3 H―C―O ║ O |
При пиролизе смешанных солей получаются несимметричные кетоны О ║ R―С―О Ca (t0C) → R―С=О + CaCO3 R/―C―O │ ║ R/ O |
6. Пиролиз карбоновых кислот в присутствии катализатора ThO2 |
|
Из двух различных молекул карбоновых кислот, одна из которых должна быть муравьиная кислота получают альдегиды. О O O ║ ║ ║ R―С―ОH + HO―C―H → R―С―H + CO2 + H2O |
Из двух одинаковых молекул карбоновых кислот получают симметричные кетоны, из двух различных карбоновых кислот - несимметричные кетоны. О O O ║ ║ ║ R―С―ОH + HO―C―R/ → R―С―R/ + CO2 + H2O |
7. Окисление спиртов в присутствии медных катализаторов |
|
Из первичных спиртов получают альдегиды [O] - CuO и Cu t = 400-6000C
R―CH2 [O] R―C=O │ → │ OH H |
Из вторичных спиртов получают кетоны [O] - CuO и Cu t = 400-6000C
R―CH―R/ [O] R―C=O │ → │ OH R/ |
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Строение карбонильной группы >С=О:
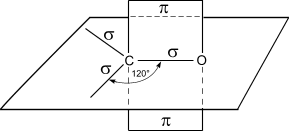
Атом углерода в карбонильной группе находится в состоянии sp2-гибридизации и образует 3σ-связи (две связи С―Н или C―C и одну связь С―О), π-связь образована р-электронами атомов углерода и кислорода. Двойная связь карбонильной группы по физической природе сходна с двойной связью между углеродными атомами. Ввиду высокой электроотрицательности атома кислорода по сравнению с атомом углерода, связь >C=O сильно поляризована за счет смещения электронной плотности π-связи к атому кислорода, в результате чего на атоме кислорода возникает частичный отрицательный (δ―), а на атоме углерода – частичный положительный (δ+) заряды:
[>C=O ↔ >Cδ+―Oδ―].
Химические свойства карбоновых кислот
I Реакции присоединения аn
В состав карбонильной группы входит двойная связь, следовательно, карбонильные соединения склонны к реакциям присоединения, как и алкены. Однако в отличие от алкенов для карбонильных соединений характерны реакции присоединения нуклеофильных частиц, т.е. отрицательно заряженные частицы (нуклеофилы) способны атаковать положительно заряженный атом углерода карбонильной группы. Еще одной отличительной особенностью химических свойств карбонильных соединений является то, что реакции обратимы из-за малой устойчивости образующихся соединений.
1) Взаимодействие с ВОДОЙ в присутствии кислот Н+ либо щелочей ОН―, в результате образуются ГЕМДИОЛЫ. Во взаимодействие с водой вступают только низшие альдегиды, так как высшие альдегиды образуют неустойчивые гемдиолы и равновесие реакции сдвинуто влево.
Пример: Н―С=О + Н2О (Н+ / ОН―) ↔ НО―СН2―ОН
формальдегид │ гемдиол (35-40% водный раствор
Н формальдегида называется формалином)
2) Взаимодействие со СПИРТАМИ в присутствии кислот либо щелочей с образованием ПОЛУАЦЕТАЛЕЙ и АЦЕТАЛЕЙ.
Например:
R/ R/ R/
│ │ │
R―С=O + H―OR// → R―C―O―R// + HO―R// → R―C―O―R// + H2O
│ │
ОН (ацеталь) O―R// (полуацеталь)
Так как карбонильные кислоты быстро окисляются, то данные реакции используют для ее защиты, т.е. сначала получают ацеталь, затем проводят необходимый синтез и только после этого снимают защиту кислотным гидролизом.
3) Взаимодействие с СИНИЛЬНОЙ КИСЛОТОЙ (HCN) в присутствии щелочи с образованием ГЕМОКСИНИТРИЛОВ.
Например:
R/ R/
│ │
R―С=O + H―C≡N (NaOH) → R―C―OH
│
C≡N (гемоксинитрил)
4) Взаимодействие с ГИДРОСУЛЬФИТОМ НАТРИЯ (NaHSO3) с образованием ГИДРОСУЛЬФИТНЫХ ПРОИЗВОДНЫХ АЛЬДЕГИДОВ и МЕТИЛКЕТОНОВ. Во взаимодействие вступают альдегиды и метилкетоны. Данную реакцию используют для выделения альдегидов из смесей с другими веществами (качественная реакция).
H H O
│ │ ║
R―С=O + NaHSO3 → R―C―S―ONa ↓
(альдегид) │ ║
OH O (осадок - гидросульфитное производное альдегида)
Сначала альдегид в виде осадка выделяют из смеси органических веществ фильтрованием, а затем возвращают альдегид нагреванием осадка в кислой среде либо его обработкой карбонатом натрия при нагревании:
Н О │ ║ R―C―S―ONa ↓ │ ║ ОН О |
+ HCl (t0C) ---------------→ R―СH=O + SO2↑ + H2O + NaCl
|
+ Na2CO3 (t0C) ---------------→ R―СH=O + NaHCO3 + Na2SO3
|
5) Взаимодействие с АММИАКОМ и АМИНАМИ, в результате образуются неустойчивые продукты присоединения, которые конденсируются с выделением воды и образованием двойной связи >C=N―. Эта реакция позволяет различать альдегиды и кетоны, так как кетоны реагируют с аммиаком и аминами более сложно, чем описано ниже. В случае взаимодействия альдегида и аммиака получаются ИМИНЫ, а из аминов образуются так называемые ОСНОВАНИЯ ШИФФА – соединения, содержащие фрагмент >C=N―R.
Например:
R/ R/ R/
│ │ │
R―С=O + H―NH2 → R―C―OH → H2O + R―C=N―H
(аммиак) │ (имин)
NH―H
R/ R/ R/
│ │ │
R―С=O + R//―NH―Н → R―C―OH → H2O + R―C=N―R//
(амин) │ (основание Шиффа)
R//―N―H
