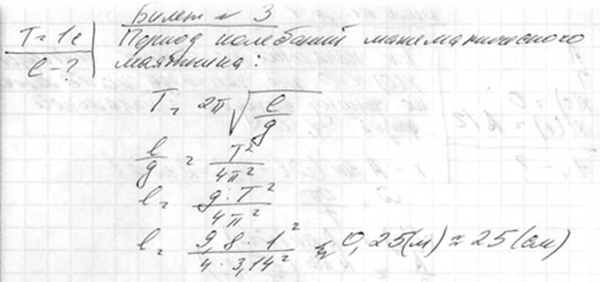- •Екзаменаційний білет № 1
- •Квантова гіпотеза та формула Планка
- •Радіоактивність
- •Екзаменаційний білет № 2
- •Ефект Комптона
- •Ядерні реакції. Реакція поділу
- •Екзаменаційний білет № 3
- •Теплове випромінювання, його основні визначення
- •Склад ядра атома. Ізотопи
- •Екзаменаційний білет № 4
- •Оптична пірометрія.
- •Закон радіоактивного розпаду
- •Екзаменаційний білет № 5
- •Закон Стефана-Больцмана
- •Енергія зв’язку ядра
- •Екзаменаційний білет № 6
- •Закон Кірхгофа.
- •Дефект маси ядра
- •Екзаменаційний білет № 7
- •Закон Малюса
- •Електронно-дірковий перехід
- •Екзаменаційний білет № 8
- •Закон Віна.
- •Ядерні сили
- •Екзаменаційний білет № 9
- •Розсіювання та поглинання світла.
- •Зонні моделі металів, діелектриків та напівпровідників
- •Екзаменаційний білет № 10
- •Поляризація світла
- •Теплові властивості твердих тіл. Закон Дюлонга і Пті, квантові теорії теплоємності
- •Екзаменаційний білет № 11
- •Закон Брюстера
- •Власна та домішкова проводимість напівпровідників
- •Екзаменаційний білет № 12
- •Електромагнітні хвилі, швидкість їх розповсюдження.
- •Екзаменаційний білет № 13
- •Інтерференція світла.
- •Експериментальні дослідження кришталів
- •Екзаменаційний білет № 14
- •Дифракція світла.
- •Кристалічна решітка, дефекти в кришталах
- •Екзаменаційний білет № 15
- •Дисперсія світла.
- •Енергетичні зони в кристалах
- •Екзаменаційний білет № 16
- •Затухаючі коливання.
- •Квантові числа, принцип Паулі
- •Екзаменаційний білет № 17
- •Коливальний контур, формула Томсона
- •Спектральні серії
- •Екзаменаційний білет № 18
- •Математичний та фізичний маятники
- •Рівняння Шредінгера
- •Екзаменаційний білет № 19
- •Хвильова функція та її статистичний зміст
- •Гармонічні коливання
- •Екзаменаційний білет № 20
- •Вимушені коливання
- •Досліди Резерфорда по розсіюванню α-частинок речовиною
- •Екзаменаційний білет № 21
- •Резонанс
- •Іонні та ковалентні молекули
- •Екзаменаційний білет № 22
- •Зовнішній фотоефект
- •Правила зміщення
- •Екзаменаційний білет № 23
- •Екзаменаційний білет № 24
- •Рівняння Ейнштейна для зовнішнього фотоефекту
- •Співвідношення невизначеностей
Екзаменаційний білет № 3
Теплове випромінювання, його основні визначення
Тепловым излучением называется электромагнитное излучение, испускаемое телами за счет их внутренней энергии.
В этом случае энергия внутренних хаотических тепловых движений частиц непрерывно переходит в энергию испускаемого электромагнитного излучения.
В обычных условиях, при комнатной температуре (Т=300 К), тепловое излучение тел происходит в инфракрасном диапазоне длин волн (l=10 мкм), недоступным зрительному восприятию глаза. С увеличением температуры светимость тел быстро возрастает, а длины волн смещаются в более коротковолновую область. Если температура достигает тысяч градусов, то тела начинают излучать в видимом диапазоне длин волн (l=0.4¸0.8 мкм).
Нагретое тело за счет теплового излучения отдает внутреннюю энергию и охлаждается до температуры окружающих тел. В свою очередь, поглощая излучение, могут нагреваться холодные тела. Такие процессы, которые могут происходить и в вакууме, называют радиационным теплообменом.
Если излучающее тело окружить оболочкой с идеально отражающей поверхностью, то через некоторое время эта система придет в состояние теплового равновесия.
Равновесным тепловым излучением называют излучение, при котором расход энергии тела на излучение компенсируется энергией поглощенного им излучения для каждой длины волны.
Из всех видов излучения только тепловое излучение может находиться в равновесии с излучающими телами.
Следует отметить, что равновесное тепловое излучение не зависит от природы тел, а зависит только от его температуры.
Энергетическая светимость тела RТ, численно равна энергии W, излучаемой телом во всем диапазоне длин волн (0<l<¥) с единицы поверхности тела, в единицу времени, при температуре телаТ, т.е.
![]() (1)
(1)
Испускательная способность тела rl,Т численно равна энергии тела dWl, излучаемой телом c единицы поверхности тела, за единицу времени при температуре тела Т, в диапазоне длин волн от lдо l+dl, т.е.
![]() (2)
(2)
Эту величину называют также спектральной плотностью энергетической светимости тела.
Энергетическая светимость связана с испускательной способностью формулой
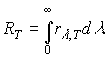 (3)
(3)
Поглощательная способность тела al,T - число, показывающее, какая доля энергии излучения, падающего на поверхность тела, поглощается им в диапазоне длин волн от l до l+dl, т.е.
 .
(4)
.
(4)
Тело, для которого aλ,T=1 во всем диапазоне длин волн, называется абсолютно черным телом (АЧТ).
Тело, для которого aλ,T =const<1 во всем диапазоне длин волн называют серым.
Склад ядра атома. Ізотопи
Атом является сложной системой, в состав которой входят определенные частицы. Английский физик Э. Резерфорд предложил ядерную (планетарную) модель строения атома. Основные положения ядерной модели атома.
Атом имеет форму шара, в центре которого находится ядро.
Ядро имеет очень маленький размер (диаметр атома 10-10 м, диаметр ядра ~10-15 м).
Ядро имеет положительный заряд.
Почти вся масса атома находится в ядре.
Вокруг ядра движутся электроны.
Электроны движутся вокруг ядра, как планеты вокруг Солнца.
Все положения модели Резерфорда, кроме последнего — шестого, современная наука считает правильными. Г. Мозли (Англия) установил, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе. Положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Менделеева. Каждый протон имеет заряд +1, поэтому заряд ядра равен числу протонов. Атом — это электронейтральная частица, поэтому положительный заряд ядра численно равен сумме отрицательных зарядов всех электронов, или числу электронов (т. к. заряд электрона равен —1) Следовательно: Порядковый номер элемента = Заряд ядра атома = Число протонов в ядре = Число электронов в атоме. Например, элемент железо Fe имеет порядковый номер 26. Следовательно, заряд ядра атома железа равен +26, т. е. ядро содержит 26 протонов, а вокруг ядра движутся 26 электронов. Элементарные частицы имеют следующие абсолютные и относительные массы:
Частица |
Обозначение |
Абсолютная масса, кг |
Относительная масса, а.е.м |
Электрон |
е- |
9,11 x 10-31 |
1/1840 |
Протон |
11p |
1,6726 x 10-27 |
1,0071 ~ 1 |
Нейтрон |
10n |
1,6750 x 10-27 |
1,009 ~ 1 |
Масса протона, как и масса нейтрона, приблизительно в 1840 раз больше массы электрона. Протоны и нейтроны находятся в ядре, поэтому масса атома почти равна массе ядра. Масса ядра, как и масса атома, определяется суммой числа протонов и числа нейтронов. Эта сумма называется массовым числом атома. Массовое число атома (A) = Число протонов (Z) + Число нейтронов (N) A=Z+N
Атомы одного элемента, которые имеют разные массовые числа, называются изотопами. Атомы изотопов одного элемента имеют одинаковое число протонов (Z) и отличаются друг от друга числом нейтронов (N). Изотопы обозначаются символами соответствующих элементов, слева от которых вверху записывают массовое число изотопа, а внизу — порядковый номер (заряд ядра атома) элемента. Например:12 6C — изотоп углерода с массовым числом 12; Иногда в символах изотопов записывают только массовые числа (12С, 18О, 27Al и т. д.)
Элемент водород имеет три изотопа, каждый из которых имеет свое название: 1 1H 2 1H (D) 3 1Н (Т) протий дейтерий тритий 1протон, нейтронов нет 1 протон, 1 протон, 1 нейтрон 2 нейтрона В названиях изотопов других элементов указываются их массовые числа. Например: 12 6С — углерод-12; В природе различные элементы имеют разное число изотопов с разным процентным содержанием каждого из них. Относительная атомная масса элемента Аr , которая приводится в периодической системе, — это средняя величина массовых чисел природных изотопов этого элемента с учетом процентного содержания каждого изотопа. Например, в природе все атомы хлора представляют собой два вида изотопов: 35Cl (процентное содержание 75,5%) и 37Сl (24,5%). Относительная атомная масса хлора:
![]()
Химические свойства всех изотопов одного элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра. Поэтому современная формулировка периодического закона читается так: Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома, или порядкового номера элемента. Формулировка периодического закона Менделеевым и современная формулировка не противоречат друг другу, потому что для большинства элементов при увеличении заряда ядра относительная атомная масса тоже увеличивается. Существуют лишь немногие исключения из этого правила. Например, элемент № 18 аргон Аг имеет меньшую атомную массу, чем элемент № 19 калий К.
Задача. При якій довжині період коливань математичного маятника буде дорівнювати 1 с?