- •КоНсПект лекций
- •Основные классы и номенклатура неорганических соединений
- •Общие положения химической номенклатуры
- •Простые вещества
- •Сложные вещества
- •Бинарные соединения
- •Многоэлементные соединения
- •Химическая термодинамика Химическая термодинамика. Основные определения
- •Первое начало термодинамики. Тепловой эффект химической реакции. Энтальпия
- •Стандартное состояние
- •Термохимические расчеты. Закон Гесса
- •Энтропия. Второе и третье начала термодинамики
- •Энергия Гиббса
- •Диаграммы Эллингема. Пирометаллургия
- •Химическая кинетика Скорость химической реакции
- •Кинетическая кривая
- •Влияние различных факторов на скорость химической реакции
- •Влияние природы реагирующих веществ
- •Влияние концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Влияние площади межфазной поверхности. Порошковая металлургия
- •Влияние температуры. Уравнение Аррениуса
- •Теория переходного состояния. Энергетические диаграммы
- •Катализ
- •Каталитический конвертор
- •Обратимые химические реакции. Химическое равновесие
- •Смещение химического равновесия. Принцип Ле Шателье
- •Растворы Основные понятия
- •Процесс растворения. Строение растворов
- •Термодинамика процесса растворения.
- •Коллигативные свойства растворов
- •Антифризы
- •Произведение растворимости
- •Процессы растворения минеральных вяжущих веществ
- •Комплексные соединения. Координационная теория Вернера. Основные положения.
- •Номенклатура комплексных соединений.
- •Изомерия комплексных соединений.
- •Особенности электролитической диссоциации комплексных соединений
- •Механизм образования химической связи в комплексных соединениях.
- •Окислительно-восстановительные процессы Электроотрицательность.
- •Степень окисления.
- •Окислительно-восстановительные реакции. Основные понятия. Типы окислителей и восстановителей.
- •Окислители
- •2. Кислородсодержащие кислоты и их соли.
- •Восстановители
- •Методы расстановки коэффициентов в уравнениях окислительно-восстановительных реакций.
- •Классификация окислительно-восстановительных реакций.
- •Основные понятия электрохимии
- •Двойной электрический слой. Электродный потенциал
- •Стандартный электродный потенциал и методы его измерения
- •Уравнение Нернста
- •Принцип работы гальванического элемента Даниэля
- •Составление схемы гальванических элементов
- •Электродвижущая сила и напряжение гальванического элемента
- •Электролиз
- •Разряжение анионов. Анодные процессы
- •Законы электролиза (законы Фарадея). Выход по току
- •Гальванотехника
- •Химия металлов Физические свойства металлов. Металлическая связь
- •Классификация металлов
- •Распространенность металлов в природе
- •Промышленное получение металлов. Металлургия
- •Химические свойства металлов
- •Полимеры. Основные понятия. Основы химии высокомолекулярных соединений Основные определения
- •Численные характеристики
- •Номенклатура
- •Классификация полимеров
- •Основные отличия полимеров от низкомолекулярных соединений
- •Производство полимеров в Беларуси
Классификация окислительно-восстановительных реакций.
Все окислительно-восстановительные реакции можно разделить на 4 основных типа:
1. Межмолекулярное окисление-восстановление. В этих реакциях окислитель и восстановитель - разные вещества, производные разных химических элементов. К таким реакциям относится большая часть окислительно восстановительных процессов:
0 +2 0 +2
Zn + CuSO4 Cu + ZnSO4
2. Компропорционирование. В реакциях этого типа окислитель и восстановитель - разные вещества, являющиеся производными одного и того же элемента, находящегося в разных степенях окисления:
+4 -2 0
H2SO3 + 2H2S 3S + 3H2O
3. Диспропорционирование. В данных реакциях функции окислителя и восстановителя совмещены в одном и том же веществе, которое является производным элемента, находящегося в промежуточной степени окисления. Причем только этот элемент изменяет свою степень окисления в ходе реакции:
+2 +3 0
3CrO Cr2O3 + Cr
4. Внутримолекулярное окисление-восстановление. В этих реакциях окислителем и восстановителем является одно и то же вещество. В результате реакции свою степень окисления меняет сразу же несколько элементов, входящих в состав этого вещества. К таким реакциям относятся прежде всего реакции термического разложения.
+5 -2 +3 0
2KNO3 2KNO2 + O2
Основные понятия электрохимии
Большое число химических реакций протекает с участием заряженных частиц (ионов или электронов) на границе раздела двух фаз (например, твердое вещество - раствор или расплав электролита). При определенных условиях в таких химических реакциях заряженные частицы участвуют в направленном движении, т.е. в цепи возникает электрический ток. Наука, изучающая физико-химические процессы, которые сопровождаются появлением электрического тока или, наоборот, возникают под действием электрического тока на химическое соединение называется электрохимией. Электрохимия имеет важное практическое значение. Знание электрохимических законов и представление о сущности электрохимических процессов позволяет создавать химические источники электрического тока (гальванические элементы, аккумуляторы, топливные элементы), получать гальванические покрытия, синтезировать как неорганические, так и органические соединения, выделять в свободном виде многие металлы и неметаллы. Кроме того, с помощью электрохимии были разработаны эффективные методы борьбы с коррозией металлов, а в последние годы интенсивно исследуются электрохимические процессы, протекающие в биологических системах.
Двойной электрический слой. Электродный потенциал
Рассмотрим процессы, протекающие на границе двух фаз с участием заряженных частиц (ионов и электронов), например, при погружении металлической пластинки в воду.
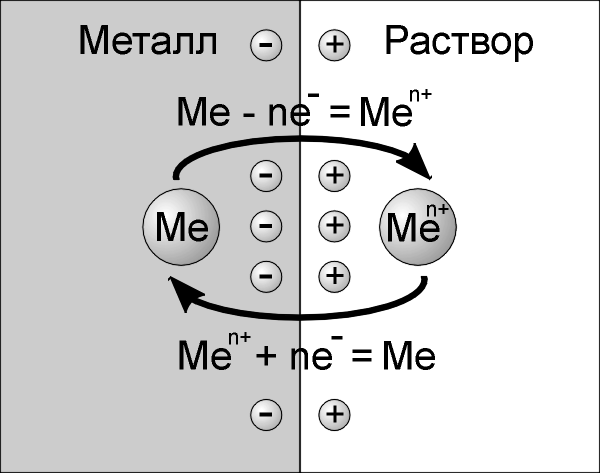
Рис.1.1. Схема, иллюстрирующая механизм образование двойного электрического слоя на границе металл-раствор.
Для всех металлов (Ме) характерно свойство в большей или меньшей степени растворятся в воде. При этом в воду переходят положительно заряженные ионы (катионы) металла (Men+), а электроны остаются на пластинке, в результате чего она приобретает отрицательный заряд. Между отрицательно заряженной поверхностью пластинки и перешедшими в раствор положительными ионами возникает электростатическое притяжение, что препятствует дальнейшему переходу ионов металла в раствор, т.е. процесс растворения металла прекращается. Одновременно развивается противоположный процесс: ионы металла из раствора, подойдя к поверхности пластины, принимают от нее электроны, превращаясь в нейтральные атомы (рис. 1.1). Таким образом, между пластинкой и раствором устанавливается окислительно-восстановительное равновесие:
Me Men+ + ne– |
(1). |
В реальных системах катионы металлов, находящиеся в растворе, всегда окружены оболочкой из полярных молекул воды, т.е. гидратированы. Поэтому более правильно процессы, протекающие при погружении металлической пластинки в воду, выражаются уравнением:
Me + mH2O Men+(H2O)m + ne– пластина раствор |
(2). |
Гидратированные катионы металла (положительный заряд), которые скопились возле поверхности пластинки (отрицательный заряд), обеспечивают возникновение на границе раздела двух фаз (металл-раствор) двойного электрического слоя (ДЭС). характеризующегося некоторой разностью электростатических потенциалов.
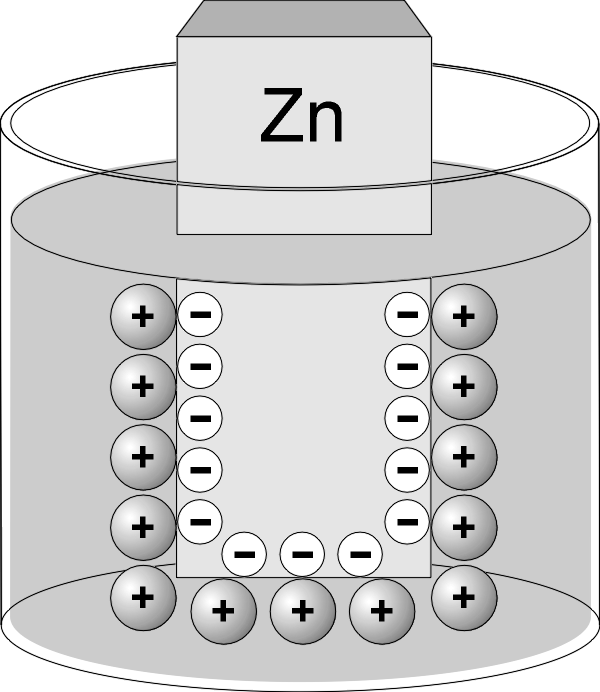
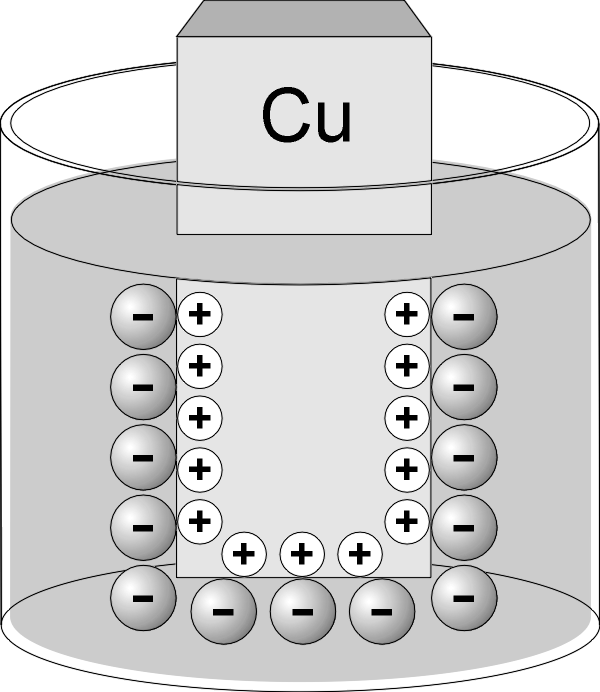
Если погрузить пластинку не в воду, а в раствор соли этого же металла, то также возникает ДЭС, но в этом случае возможны два механизма его образования. Если концентрация катионов металла в растворе мала или металл достаточно активный (например, цинк), то равновесие процесса (2) сдвигается вправо, вследствие чего пластина заряжается отрицательно (рис. 1.2.а). В том случае, когда концентрация катионов металла в растворе велика или металл малоактивный (например, медь), равновесие процесса (2) сдвигается влево и металлическая пластинка заряжается положительно (рис. 1.2.б).
|
|
а. |
б. |
Рис.1.2. Образование ДЭС в случае активного (цинк) и малоактивного (медь) металлов.
Поскольку в случае двойного электрического слоя металл и жидкая фаза (раствор) имеют заряды противоположного знака, между ними возникает определенная разность потенциалов, которая называется электродным потенциалом (Е). Электродному потенциалу металла приписывается тот знак, который возникает на его поверхности в двойном электрическом слое.
Таким образом, пластинка металла и раствор его соли вместе составляют единую окислительно-восстановительную систему, характеризующуюся определенным электродным потенциалом, который зависит от природы металла и растворителя, концентрации его ионов в растворе, от температуры и рН среды.