
- •КоНсПект лекций
- •Основные классы и номенклатура неорганических соединений
- •Общие положения химической номенклатуры
- •Простые вещества
- •Сложные вещества
- •Бинарные соединения
- •Многоэлементные соединения
- •Химическая термодинамика Химическая термодинамика. Основные определения
- •Первое начало термодинамики. Тепловой эффект химической реакции. Энтальпия
- •Стандартное состояние
- •Термохимические расчеты. Закон Гесса
- •Энтропия. Второе и третье начала термодинамики
- •Энергия Гиббса
- •Диаграммы Эллингема. Пирометаллургия
- •Химическая кинетика Скорость химической реакции
- •Кинетическая кривая
- •Влияние различных факторов на скорость химической реакции
- •Влияние природы реагирующих веществ
- •Влияние концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Влияние площади межфазной поверхности. Порошковая металлургия
- •Влияние температуры. Уравнение Аррениуса
- •Теория переходного состояния. Энергетические диаграммы
- •Катализ
- •Каталитический конвертор
- •Обратимые химические реакции. Химическое равновесие
- •Смещение химического равновесия. Принцип Ле Шателье
- •Растворы Основные понятия
- •Процесс растворения. Строение растворов
- •Термодинамика процесса растворения.
- •Коллигативные свойства растворов
- •Антифризы
- •Произведение растворимости
- •Процессы растворения минеральных вяжущих веществ
- •Комплексные соединения. Координационная теория Вернера. Основные положения.
- •Номенклатура комплексных соединений.
- •Изомерия комплексных соединений.
- •Особенности электролитической диссоциации комплексных соединений
- •Механизм образования химической связи в комплексных соединениях.
- •Окислительно-восстановительные процессы Электроотрицательность.
- •Степень окисления.
- •Окислительно-восстановительные реакции. Основные понятия. Типы окислителей и восстановителей.
- •Окислители
- •2. Кислородсодержащие кислоты и их соли.
- •Восстановители
- •Методы расстановки коэффициентов в уравнениях окислительно-восстановительных реакций.
- •Классификация окислительно-восстановительных реакций.
- •Основные понятия электрохимии
- •Двойной электрический слой. Электродный потенциал
- •Стандартный электродный потенциал и методы его измерения
- •Уравнение Нернста
- •Принцип работы гальванического элемента Даниэля
- •Составление схемы гальванических элементов
- •Электродвижущая сила и напряжение гальванического элемента
- •Электролиз
- •Разряжение анионов. Анодные процессы
- •Законы электролиза (законы Фарадея). Выход по току
- •Гальванотехника
- •Химия металлов Физические свойства металлов. Металлическая связь
- •Классификация металлов
- •Распространенность металлов в природе
- •Промышленное получение металлов. Металлургия
- •Химические свойства металлов
- •Полимеры. Основные понятия. Основы химии высокомолекулярных соединений Основные определения
- •Численные характеристики
- •Номенклатура
- •Классификация полимеров
- •Основные отличия полимеров от низкомолекулярных соединений
- •Производство полимеров в Беларуси
Термодинамика процесса растворения.
Растворение веществ сопровождается тепловым эффектом, т.е. либо поглощением, либо выделением энергии. Количество тепла, выделяющееся или поглощающееся при растворении одного моля вещества называется теплотой растворения.
При растворении в жидкостях твердых веществ протекает два основных процесса. Во-первых, разрушается кристаллическая решетка вещества, что сопровождается поглощением энергии. Во-вторых, образуются сольваты, что сопровождается выделением энергии. В большинстве случаев растворение твердых веществ - эндотермический процесс (Н>0), протекающий с увеличением энтропии (S>0). По этой причине с увеличением температуры растворимость большинства твердых веществ в жидкостях возрастает.
Растворение в жидкостях газов или других жидкостей обычно сопровождается выделением теплоты (H<0). Энтропия при растворении газов уменьшается (S<0).
Коллигативные свойства растворов
К коллигативным относятся такие свойства растворов, которые определяются только концентрацией растворенного вещества и не зависят от химического состава раствора. Коллигативные свойства относятся только к растворам, содержащим нелетучие растворимые вещества.
1. Понижение температуры замерзания раствора. При понижении температуры в чистом растворителе происходит постепенное уменьшение кинетической энергии частиц. Силы притяжения становятся преобладающими. Поэтому при определенной температуре (ТКР) все частицы оказываются фиксированными в определенных положениях - узлах кристаллической решетки. В растворах же частицы растворенного вещества препятствуют образованию строго упорядоченной кристаллической структуры. В результате температура замерзания раствора оказывается меньшей, чем у чистого растворителя.
Понижение температуры замерзания раствора (ТКР) определяется из соотношения:
ТКР = KСm, |
(1.1) |
где K - криоскопическая постоянная растворителя, Сm - моляльная концентрация раствора. Криоскопическая постоянная определяется природой растворителя. Ее значения для некоторых растворителей приведены в табл. 1.1.
Таблица 1.1. Криоскопические постоянные некоторых растворителей.
Вещество |
Диэтиловый эфир |
Вода |
Уксусная кислота |
Бензол |
Циклогексан |
Камфора |
K, Kмоль–1кг |
1.73 |
1.86 |
3.90 |
5.12 |
20 |
40 |
2. Понижение давления насыщенного пара растворителя. Частицы чистого растворителя могут переходить в газовую фазу со всей поверхности жидкости, а в растворе частицы растворенного вещества затрудняют такой переход (рис. 1.1). Поскольку растворимое вещество нелетуче, то давление пара создается исключительно частицами растворителя и, следовательно давление насыщенного пара над раствором будет меньше, чем над чистым растворителем.
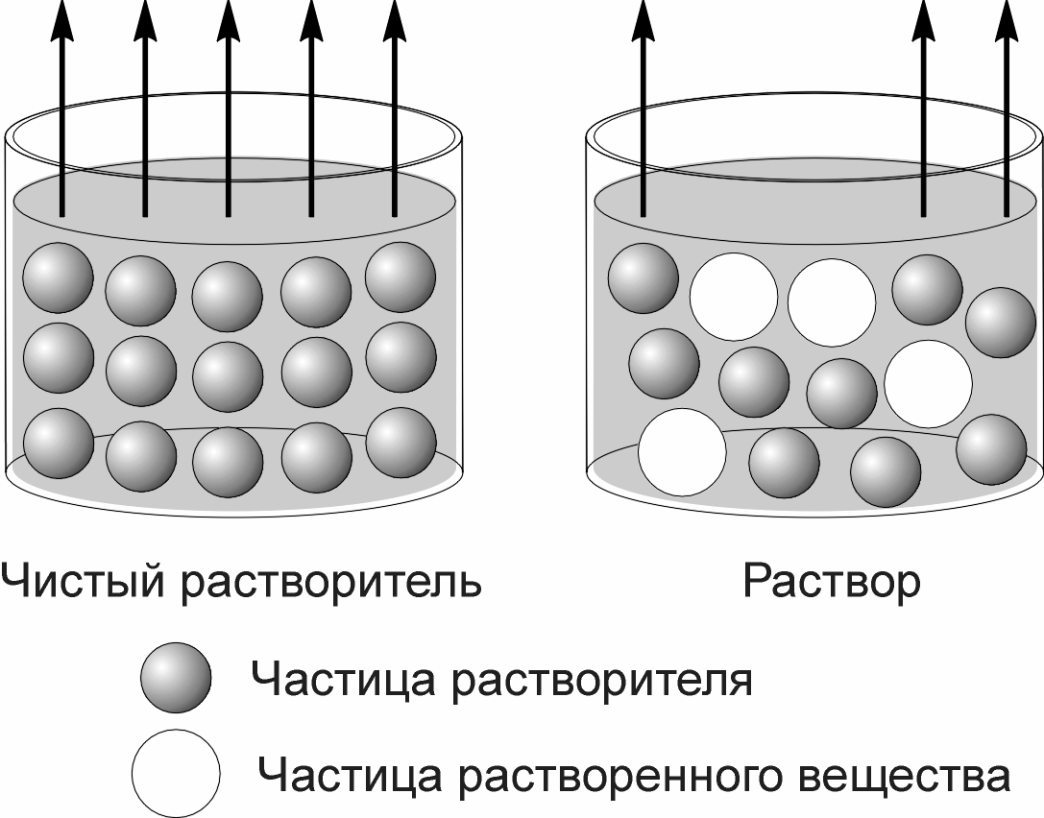
Рис.1.1 Схема, иллюстрирующая причину понижения
давления насыщенного пара растворителя над раствором.
Понижение давления насыщенного пара растворителя (p) можно определить по закону Рауля:
p = Nр.в-ваp0, |
(1.2) |
где Nр.в-ва – молярная доля растворенного вещества, p0 – давление насыщенного пара над чистым растворителем. Значения p0 для воды в зависимости от температуры приведены в табл. 1.2.
Таблица 1.2. Давление насыщенного водяного пара, находящегося в равновесии с водой.
T, C |
p0, кПа |
t, C |
p0, кПа |
t, C |
p0, кПа |
10 |
1.2270 |
18 |
2.062 |
25 |
3.166 |
12 |
1.4014 |
20 |
2.337 |
26 |
3.360 |
14 |
1.597 |
22 |
2.642 |
28 |
3.778 |
16 |
1.817 |
24 |
2.982 |
30 |
4.241 |
3. Повышение температуры кипения раствора. Как уже было показано выше, частицы растворенного вещества мешают молекулам растворителя покидать поверхность раствора. По этой причине не только понижается давление насыщенного пара, но и повышается температура кипения раствора.
Повышение температуры кипения раствора (ТКИП) определяется из соотношения:
ТКИП = ЕСm , |
(1.3) |
где Е – эбуллиоскопическая постоянная растворителя, Сm – моляльная концентрация раствора. Эбуллиоскопическая постоянная определяется природой растворителя. Ее значения для ряда растворителей приведены в табл. 1.3.
Таблице 1.3. Эбуллиоскопические постоянные некоторых растворителей.
Вещество |
Диэтиловый эфир |
Вода |
Уксусная кислота |
Бензол |
Циклогексан |
Камфора |
Е, Kмоль–1кг |
2.02 |
0.51 |
3.07 |
2.57 |
2.75 |
6.09 |
4. Осмотическое давление. Осмосом называется самопроизвольный переход растворителя через полупроницаемую мембрану из разбавленного раствора или чистого растворителя в более концентрированный раствор. Полупроницаемой называется мембрана, которая пропускает частицы растворителя, но непроницаема для частиц растворенного вещества. Осмотическим давлением () называется давление, которое нужно приложить к концентрированному раствору, чтобы воспрепятствовать переносу растворителя через полунепроницаемую мембрану. Для расчета осмотического давления используется закон Вант-Гоффа:
= CMRT, |
(1.4) |
где CM – молярная концентрация раствора, R – универсальная газовая постоянная (R = 8.31 Дж/мольK), Т – температура в K (Т = t + 273).
При решении задач на расчет осмотического давления важно правильно учесть размерность величин. Для того, чтобы получить значение в паскалях, размерность концентрации должна быть выражена в моль/м3 (1 моль/м3=1000 моль/л).
В случае растворов, содержащих диссоциирующие вещества коллигативные свойства проявляются наиболее сильно. Фактор, учитывающий распад электролитов в растворах на ионы называется изотоническим коэффициентом Вант-Гоффа (i). Он показывает во сколько раз увеличилось общее количество частиц растворенного вещества в результате диссоциации. Поэтому в случае электролитов для расчета коллигативных свойств следует использовать следующие формулы:
ТКР = iКСm ТКИП = iЕСm = iCMRT
![]() ,
,
где nр.в-ва – число молей растворенного вещества, nр-ля – число молей растворителя.
