
- •Глава 1 Введение
- •Глава 2 Свойства и типы стволовых клеток
- •II фаза терапии – расширение клеточных линий
- •III фаза терапии- дифференцированные предшественники клеток
- •Глава 3 Эмбриональные стволовые клетки
- •Глава 4 Взрослые стволовые клетки
- •Глава 5 Современное лечение
- •Глава 6 Стволовые клетки и тканевая инженерия
- •Глава 7 Стволовые клетки в генной терапии
- •Глава 8 Раковые стволовые клетки
- •Глава 9 Стволовые клетки в зубной ткани
- •Глава 10 Заключение
Глава 5 Современное лечение
В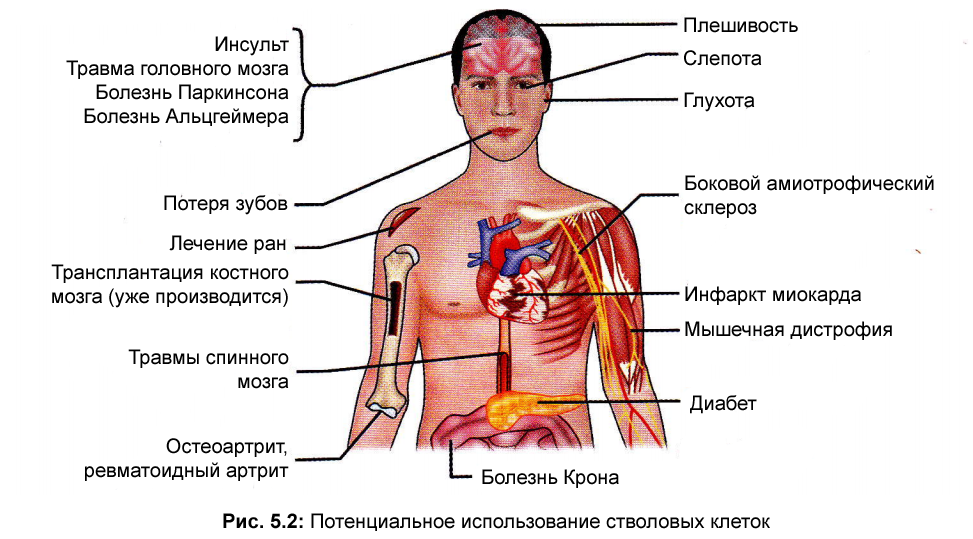 зависимости от метода лечения применяются
различные регулирующие системы. Между
этими методами сделано разграничение:
в одном случае стволовые клетки
продуцируют лекарственные вещества,
оказывающие лечебное действие, в другом
(немедикаментозном) – эти клетки берут
на себя или усиливают функцию нормальных
тканей. В настоящее время варианты
лечения болезней включают в себя:
зависимости от метода лечения применяются
различные регулирующие системы. Между
этими методами сделано разграничение:
в одном случае стволовые клетки
продуцируют лекарственные вещества,
оказывающие лечебное действие, в другом
(немедикаментозном) – эти клетки берут
на себя или усиливают функцию нормальных
тканей. В настоящее время варианты
лечения болезней включают в себя:
длительную лекарственную терапию: человеческие стволовые клетки также могут быть использованы в испытании новых лекарственных средств. Например, новые медикаменты могут быть проверены на безопасность на дифференцированных клетках, выращенных из человеческих плюрипотентных клеточных культур. Другие виды клеточных культур уже нашли своё применение в этой области. Культуры опухолевых клеток, например, использованы в экспериментах с потенциальными противоопухолевыми препаратами. Однако, перспективность плюрипотентных стволовых клеток могла бы позволить испытание лекарств в более широком диапазоне типов клеток. Так или иначе, чтобы эффективно исследовать лекарственные средства, должны быть созданы идентичные условия для сравнения различных лекарственных препаратов. Поэтому ученым придется строго контролировать дифференцировку стволовых клеток в специфические их типы, на которых в будущем будут протестированы лекарства. Новые исследования показывают, что возможно управлять дифференцировкой человеческих эмбриональных стволовых клеток в клеточной культуре для того, чтобы создать инсулин-продуцирующие клетки, которые в итоге могут быть использованы в трансплантационной терапии у диабетиков.
трансплантацию: возможно самое важное потенциальное применение человеческих стволовых клеток заключается в производстве клеток и тканей, которые могут быть использованы для клеточной терапии. Сегодня донорские органы и ткани часто используются для замены нездоровой или разрушенной ткани, но нужда в трансплантируемых тканях и органах превосходит возможности их заимствования. Управляемые стволовые клетки дифференцирующиеся в определенные типы клеток, открывают обновляемый источник пересаживаемых клеток и тканей для лечения таких заболеваний, как болезни Паркинсона и Альцгеймера, травмы спинного мозга, ожогов, заболеваний сердца, диабета, остеоартрита, ревматоидного артрита.
Чтобы реализовать возможности новой клеточной терапии для таких распространенных и калечащих заболеваний, ученым необходимо в полной мере научиться манипулировать стволовыми клетками для того, чтоб они приобретали необходимые характеристики для успешной дифференцировки, трансплантации и приживления. Ниже будет перечислен список шагов успешного лечения клетками, который ученые должны освоить, чтоб под строгим контролем ввести такое лечение в практику. Чтобы быть пригодными для пересадки, стволовые клетки должны:
экстенсивно пролиферировать и образовывать достаточные количества ткани;
дифференцироваться в ожидаемые типы клеток;
выживать в организме реципиента после трансплантации;
интегрироваться с окружающими тканями после пересадки;
функционировать должным образом на протяжении всей жизни реципиента;
не причинять какого-либо вреда реципиенту.
Так же во избежание проблемы иммунного отторжения ученые экспериментируют, используя различные научные методы для производства тканей, которые не будут отторгаться.
м
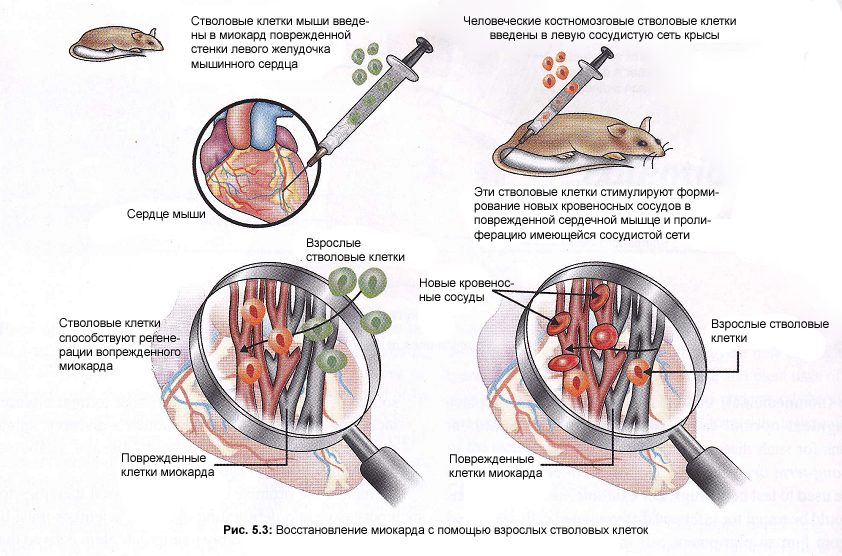 едицинские
приспособления, такие как водители
ритма, бессосудистые трансплантаты,
ортопедические соединения и протезируемые
сердечные клапаны. Такие приспособления
безусловно должны быть заменены на всю
оставшуюся пациенту жизнь (Рис.5.3.).
едицинские
приспособления, такие как водители
ритма, бессосудистые трансплантаты,
ортопедические соединения и протезируемые
сердечные клапаны. Такие приспособления
безусловно должны быть заменены на всю
оставшуюся пациенту жизнь (Рис.5.3.).
Болезнь Паркинсона
Э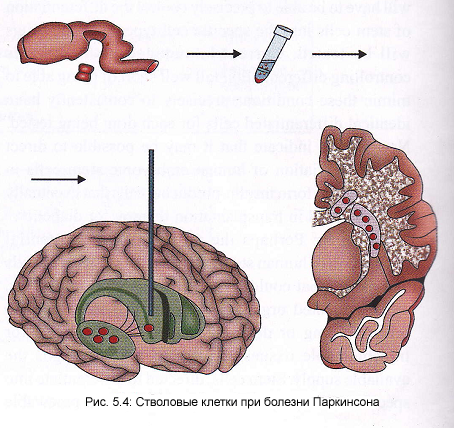 то
второе по распространенности
нейродегенеративное заболевание,
встречающееся почти у 1% людей в возрасте
старше 60 лет. Больные преимущественно
страдают от моторных нарушений, таких
как брадикинезия (замедленность
движений), ригидность (мышечная
тугоподвижность) и тремор покоя. Эти
симптомы со временем прогрессируют;
помимо этого, у большей части пациентов
с течением заболевания возникают
вегетативные расстройства, депрессия
и деменция. Главное нейропатологическое
звено болезни – это прогрессирующее
снижение количества допаминэргических
нейронов в компактной части черной
субстанции. Эти нейроны направляются
к бледному шару, и их потеря ведет к
снижению стриатарного допамина (Рис.5.4).
то
второе по распространенности
нейродегенеративное заболевание,
встречающееся почти у 1% людей в возрасте
старше 60 лет. Больные преимущественно
страдают от моторных нарушений, таких
как брадикинезия (замедленность
движений), ригидность (мышечная
тугоподвижность) и тремор покоя. Эти
симптомы со временем прогрессируют;
помимо этого, у большей части пациентов
с течением заболевания возникают
вегетативные расстройства, депрессия
и деменция. Главное нейропатологическое
звено болезни – это прогрессирующее
снижение количества допаминэргических
нейронов в компактной части черной
субстанции. Эти нейроны направляются
к бледному шару, и их потеря ведет к
снижению стриатарного допамина (Рис.5.4).
С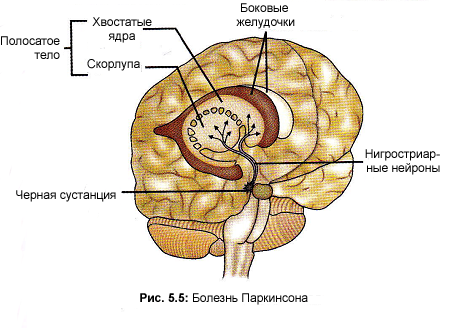 тволовые
клетки дают надежду страдающим болезнью
Паркинсона, которая вызвана гибелью
нервных клеток в мозге. Эти нервные
клетки продуцируют нейтротрансмиттер,
называемый допамином. Если из стволовых
клеток будет возможно вырастить эти
допамин-продуцирующие нервные клетки,
ученые верят, что будет возможно
пересадить их на место утерянных
нейронов. Для этого рассекают передний
мезэнцефалон абортивных эмбрионов
после разъяснений и согласия женщины
на предстоящий аборт с учетом этических
норм. Полученная ткань ферментативно
и механически разобщается, хранится
несколько недель и имплантируется
лоскутом или трансплантируется по
частям. Клетки вводятся стереотаксически
в скорлупу или хвостатое ядро (Рис.5.5).
тволовые
клетки дают надежду страдающим болезнью
Паркинсона, которая вызвана гибелью
нервных клеток в мозге. Эти нервные
клетки продуцируют нейтротрансмиттер,
называемый допамином. Если из стволовых
клеток будет возможно вырастить эти
допамин-продуцирующие нервные клетки,
ученые верят, что будет возможно
пересадить их на место утерянных
нейронов. Для этого рассекают передний
мезэнцефалон абортивных эмбрионов
после разъяснений и согласия женщины
на предстоящий аборт с учетом этических
норм. Полученная ткань ферментативно
и механически разобщается, хранится
несколько недель и имплантируется
лоскутом или трансплантируется по
частям. Клетки вводятся стереотаксически
в скорлупу или хвостатое ядро (Рис.5.5).
Сахарный диабет
Патология сахарного диабета I типа связана с аутоиммунным разрушение или недостаточной функцией β-клеток поджелудочной железы и, следовательно, недостатком инсулина. Отсутствие инсулина жизнеопасно, поэтому больные вынуждены ежедневно путём инъекции вводить гормон из экзогенных источников; тем не менее, не в полнее адекватно заменяют функцию β-клеток. В результате развития диабета возникают такие осложнения, как нейропатия, нефропатия, ретинопатия и различные сердечнососудистые нарушения. Новые исследования показывают, что может быть возможным управление дифференцировкой человеческих эмбриональных стволовых клеток в инсулин-продуцирующие клетки, которые могут быть использованы для трансплантации диабетикам.
П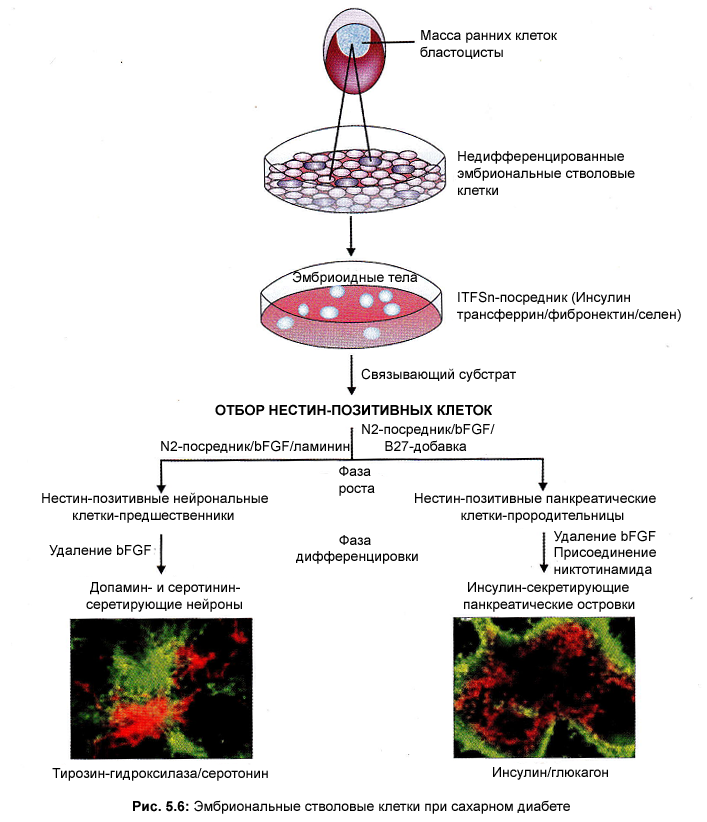 олучение
новых β-клеток из стволовых, эмбриональных
или взрослых, всё еще на ранней стадии
развития. Каждое новое сообщение
преисполнено возбуждения и скептицизма.
Продолжающиеся попытки и доскональная
оценка дают надежду, что будет создано
достаточно новых клеток из стволовых.
(Рис.5.6.).
олучение
новых β-клеток из стволовых, эмбриональных
или взрослых, всё еще на ранней стадии
развития. Каждое новое сообщение
преисполнено возбуждения и скептицизма.
Продолжающиеся попытки и доскональная
оценка дают надежду, что будет создано
достаточно новых клеток из стволовых.
(Рис.5.6.).
НЕМЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
Самая актуальная терапия стволовыми клетками, немедикаментозная по натуре, применяет замену, восстановление или регенерацию различных функций человеческого организма.
Немодифицированные стволовые клетки использованы в трансплантологии: простейшая терапия включает в себя трансплантацию тканей, содержащих стволовые клетки. Например, костномозговые трансплантаты, плацентарные стволовые клетки (которые используются в лечении различных заболеваний) и фетальные стволовые клетки (использованы в лечении болезни Паркинсона с ограниченным успехом).
Значительно модифицированные или подверженные инженерному процессу стволовые клетки: такие клетки могут быть использованы для замены (костей, сердечных клапанов, сосудов), восстановления (нервной ткани, кожи или мышц) или регенерации (печени и пожделудочной железы).
ИССЛЕДОВАНИЕ СТВОЛОВЫХ КЛЕТОК И РЕГЕНЕРАТИВНАЯ МЕДИЦИНА
Введение
В последнее время стволовые клетки раскручены в СМИ, как обещающие новый инструмент в лечении дегенеративных заболеваний. Тем не менее, множество сведений замедляет введение клеточной терапии в повседневную практику. Полное осмысление стволовых клеток в их большом количестве форм и их потомков дают повод надеяться, что они станут доминирующими в использовании в будущем. Большое внимание уделяется человеческим эмбриональным стволовым клеткам (hESCs). С момента открытия hESCs были обнаружены и другие источники стволовых клеток, один из которых – hEGCs, эти клетки можно заменить, оставив возможность плюрипотентности. Человеческие эмбриональные зародышевые клетки также могут служить как дополнительный инструмент в борьбе с болезнями.
Первичные половые клетки
Э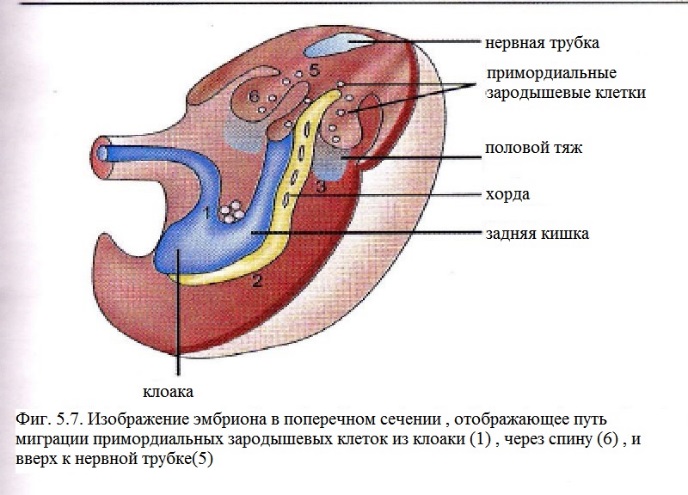 мбриональные
зародышевые клетки (EGCs)
являются производными первичных
зародышевых клеток (PGCs).
Они изолированы от полового тяжа и
мезенхимы фетальной ткани. PGCs
– это эмбриональные предшественники
гамет, и когда они стают зрелыми, из них
образуются сперматозоиды и яйцеклетки.
PGCs
начинают определятся в основании
аллантоиса на 7 день в эмбрионе мыши,
как скопление лежащих рядом клеток.
Оттуда PGCs
распространяются на эндодерму, мигрируют
через заднюю кишку и, в конце концов,
остаются на половом тяже. Для миграции
в пределах задней кишки необходим фактор
стволовых клеток (SCF)/c-kit.
Миграция из задней кишки в половой тяж
длится в течение 9,5 дней развития мышиного
эмбриона и происходит под действием
факторов, выделяемых половым тяжом.
(Рис.5.7.)
Один
из таких факторов, который важен для
привлечения PGCs
к половому тяжу – это белковый фактор
роста – стромопроизводный фактор-1
(SDF-1),
образуемый стромальными клетками
полового тяжа и гонад, который
взаимодействует с CXCR4-рецепторами,
представленными на PGCs.
мбриональные
зародышевые клетки (EGCs)
являются производными первичных
зародышевых клеток (PGCs).
Они изолированы от полового тяжа и
мезенхимы фетальной ткани. PGCs
– это эмбриональные предшественники
гамет, и когда они стают зрелыми, из них
образуются сперматозоиды и яйцеклетки.
PGCs
начинают определятся в основании
аллантоиса на 7 день в эмбрионе мыши,
как скопление лежащих рядом клеток.
Оттуда PGCs
распространяются на эндодерму, мигрируют
через заднюю кишку и, в конце концов,
остаются на половом тяже. Для миграции
в пределах задней кишки необходим фактор
стволовых клеток (SCF)/c-kit.
Миграция из задней кишки в половой тяж
длится в течение 9,5 дней развития мышиного
эмбриона и происходит под действием
факторов, выделяемых половым тяжом.
(Рис.5.7.)
Один
из таких факторов, который важен для
привлечения PGCs
к половому тяжу – это белковый фактор
роста – стромопроизводный фактор-1
(SDF-1),
образуемый стромальными клетками
полового тяжа и гонад, который
взаимодействует с CXCR4-рецепторами,
представленными на PGCs.
Свойства EGC- и ESC-клеток
Эмбриональные зародышевые клетки (EGCs) и эмбриональные стволовые клетки (ESCs) имеют несколько схожих характеристик. Оба типа клеток делятся длительный период времени, не выявляют хромосомных аномалий и показывает набор маркеров, считающимися характерными для плюрипотентных клеток. Когда состояние культуры скорректировано для дальнейшей дифференцировки, оба типа клеток (EGC и ESC) могут спонтанно дифференцироваться в дериваты начальных зародышевых листков, эндодермы, мезодермы и эктодермы. Для сравнения: ESCs получены из глубоких клеточных масс 5-дневного эмбриона, тогда как EGCs получены из полового тяжа на 5-9 неделе утробной жизни. Дополнительные эксперименты с использование hESCs показывают формирование тератом. Этот пример формирования тератомы использован как стандартное подтверждение плюрипотентности hESCs при введении их в NOD/SCID (иммуносупрессированых) мышей. Хотя известно, что hESCs образуют тератомы, приживление hESCs иммуносупрессированным мышам в действительности не вызывает формирование тератом. По сути, было показано, как эмбриональные стволовые клетки и эмбриональные зародышевые клетки из отобранных групп при их введении формируют тератомы. Но этим клеткам наоборот только предстоит показать это свойство. На сегодняшний день тератомы при анализе in vivo hEGCs не наблюдались.
Импринтинг
И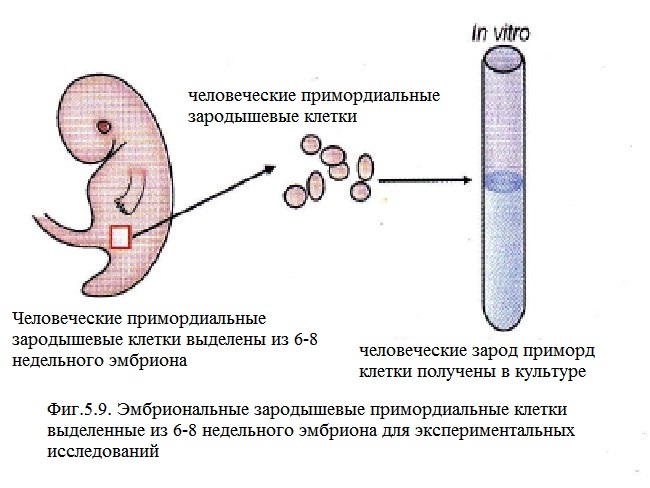 мпринтинг
- статус (состояние импринтинга)
эмбриональных зародышевых клеток -
главный вопрос в изучении их потенциала
в клиническом использовании. Импринтинг
- это эпигенетическое изменение ДНК, в
котором очевидна экспрессия только
одной из родительских аллелей.
Эпигенетические изменения - повреждения
белков, окружающих ДНК, но не самой
молекулы ДНК, с вовлечением метилирования
ДНК и модификацией гистона. Импринтинг
- необходимый процесс для нормального
функционирования, вовлекает более 100
генов. Уничтожение имринтов между
поколениями должно происходить таким
образом, чтобы гаметы обоих полов могли
быть сформированы и экспрессированы.
Это важно и потому, что собственно
экспрессия может встречаться при
комбинации двух участков ДНК. Исследования
на эмбриональных зародышевых клетках
показали мышей показали, что ткани или
дифференцрованные клетки зачастую не
могут проявлять импринтированные гены
должным образом. Изучение человеческих
эмбриональных зародышевых клетках
показали иные результаты, и, что более
важно, - нормальный импринтинг. Понимание
того, когда происходит уничтожение
импринтов, необходимо для получения
эмбриональных зародышевых клеток без
уничтожения импринтов, что важно для
терапевтического использования.
(Рис.5.9.)
Считается,
что уничтожение начинается в то время,
когда начинается развитие полового
тяжа. Большая часть демитилизаций
встречается в первый день образования
полового тяжа.
мпринтинг
- статус (состояние импринтинга)
эмбриональных зародышевых клеток -
главный вопрос в изучении их потенциала
в клиническом использовании. Импринтинг
- это эпигенетическое изменение ДНК, в
котором очевидна экспрессия только
одной из родительских аллелей.
Эпигенетические изменения - повреждения
белков, окружающих ДНК, но не самой
молекулы ДНК, с вовлечением метилирования
ДНК и модификацией гистона. Импринтинг
- необходимый процесс для нормального
функционирования, вовлекает более 100
генов. Уничтожение имринтов между
поколениями должно происходить таким
образом, чтобы гаметы обоих полов могли
быть сформированы и экспрессированы.
Это важно и потому, что собственно
экспрессия может встречаться при
комбинации двух участков ДНК. Исследования
на эмбриональных зародышевых клетках
показали мышей показали, что ткани или
дифференцрованные клетки зачастую не
могут проявлять импринтированные гены
должным образом. Изучение человеческих
эмбриональных зародышевых клетках
показали иные результаты, и, что более
важно, - нормальный импринтинг. Понимание
того, когда происходит уничтожение
импринтов, необходимо для получения
эмбриональных зародышевых клеток без
уничтожения импринтов, что важно для
терапевтического использования.
(Рис.5.9.)
Считается,
что уничтожение начинается в то время,
когда начинается развитие полового
тяжа. Большая часть демитилизаций
встречается в первый день образования
полового тяжа.
Образование человеческих эмбриональных зародышевых клеток.
Чтобы понять, как развиваются человеческие эмбриональные зародышевые клетки, важно предварительно выяснить, как эти клетки функционируют у мышей. (Рис.5.10.) Эмбриональные зародышевые клетки мышей были открыты за несколько лет до человеческих. Это происходила в условиях культивирования с использованием технических характеристик, разработанных для человеческих клеток. Были найдены такие важные факторы, как фактор стволовых клеток, базовый фактор роста фибробластов, фактор, ингибирующий лейкемию, что позволило увеличить увеличить репликацию и повысить выживаемость примордиальных зародышевых клеток, создать ключ для их культивирования. Культуры примордиальных зародышевых клеток формируют колонии клеток, похожих на эмбриональные зародышевые клетки мышей. Первоначальная характеристика показала, что клетки были позитивны по отношению к такому эмбриональному антигену, специфичному для каждой стадии. Клетки также поддерживаются за счет питающего слоя.
Человеческие эмбриональные зародышевые клетки впервые были получены в 1998 году группой, организованной Джоном Гехартом. Половые тяжи и брыжейки 5-9 -недельных зародышей после медикаментозных абортов были химически и механически разделены, пассированы на фибробласты мышей и затем культивированы на растительной среде, содержащей фетальную бычью сыворотку, фактор, ингибирующий лейкемию, базовый фактор роста фибробластов и форсколин. Значительная часть клеток имела маркеры, аналогичные стволовым клеткам и морфологически аналогичные эмбриональным зародышевым клеткам мышей . Также исследования показали , что часть клеток имела нормальный и стабильный кариотип на протяжении более 10 пассажей . В случае , когда культивирование происходило без фактора , ингибирующего лейкемию , базового фактора роста фибробластов и форсколина , in vitro плюрипотентность клеток становилась возможной . Результатом стал рост различных клеток с каждого зародышевого уровня в соответствии с наиболее важными критериями плюрипотентности . Позже другие группы получили человеческие эмбриональные зародышевые клетки , используя аналогичные методики . Эмбриональные зародышевые клетки в дальнейшей показали экспрессию гена Oct-4 и теломеразную активность , что является важнейшими свойствами эмбриональных зародышевых клеток .
Пролиферация
Примордиальные зародышевые клетки могут быть временно культивированы на питающем клеточном слое, выделяющем трансмембранно связывающую изоформу фактора стволовых клеток вместе с фактором, ингибирующим лейкемию, способствующем росту примордиальных клеток путем проявления апоптоза. Базовый фактор роста фибробластов также активен в культуре примордиальных зародышевых клеток, усиливает пролиферацию зародышевых клеток. Если клетки были культивированы с фактором, ингибирующем лейкемию, базовым фактором роста фибробластов, они могут формировать линии клеток, называющиеся эмбриональными зародышевыми клетками. Это может служить дополнением к тому факту, что получение долгосрочных и здоровых культур клеток, описанных ранее , менее успешно. То есть они необладают плюрипотентностью или не имеют так называемых "стволовых" маркеров, это означает то, что они. Могут быть более зрелыми или чуть более дифференцированными, чем человеческие эмбрионалтные стволовые клетки. Эмбриональные стволовые клетки, утерявшие стволовые свойства и оставшиеся в культуре, повторяют судьбу пимордиальных зародышевых клеток в эмбрионе или подвергаются повреждающему импринтингу и уничтожению в кульуре.
Клиническое применение
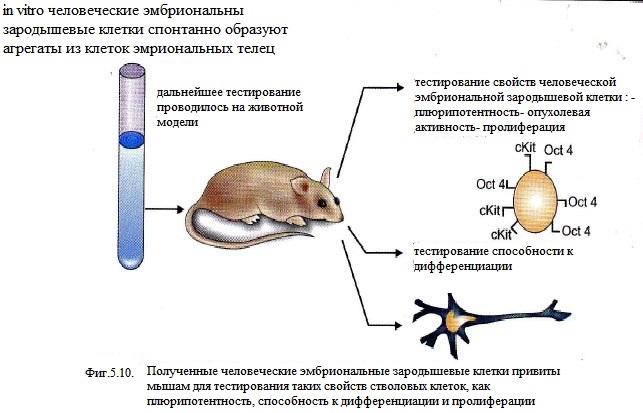
Человеческие эмбриональные зародышевые клетки формируют эмбриональные тельца в культуре в соответствии их плюрипотентной способности. Клетки эмбриональных телец - кластеры клеток, формирующиеся в тот период, когда эмбриональные зародышевые клетки агрегируются и дифференцируются в предшественники эмбриональных зародышевых клеток, имитирующие условия раннего эмбрионального развития. К сожалению, существует только один путь выявления плюрипотентности клеток - формирование химерических потомств (на опытах с мышами), но в этических соображениях на практике это не применяется. Целью современных исследований является поиск нормальных клеток, которые могли бы функционировать in vivo. Поколения эмбриональных телец необходимы для применения в регенеративной медицине , поскольку является важной ступенью в получении других клеточных линий. In vitro эксперименты с клетками эмбриональных телец дали многообещающие результаты в отношении получения нервных и мышечных клеток. Дифференцировка нервных клеток эмбриональных телец, полученных из эмбриональных зародышевых клеток показала выработку типичных маркеров предшественников, таких как нестин и нейронная молекула клеточной адгезии. При длительном нахождении в культуре клетки стали физически похожими на нейроны, образуя длинные трубчатые выросты для контакта с другими клеточными агрегатами. В других исследованиях их генетическая экспрессия и синтез белка происходили по модели хрящевой и мезенхимальной дифференциации. Особоый клинический интерес составляют эксперименты с человеческими эмбриональными клетками in vivo, но они ограничены в количестве. В последующем время человеческие эмбриональные зародышевые клетки, полученные из клеток эмбриональных телец, были имплантированы в поврежденные нервные ткани парализованных мышей. Через некоторое время животные, перенесшие трансплантацию, восстановили свои функции, в то время как другая, контрольная, группа оставалась парализованной. Эта заслуга не могла быть присвоена непосредственно трансплантированным клеткам, хотя ученые полагают, что именно они обеспечивают рост новых клеток и предотвращают гибель старых нервных клеток. Позже человеческие нервные стволовые клетки показали возможность восстановления поврежденного мозга у новорожденных мышей. Это означает, что стволовые нервные клетки имели способность прижиться и заменить утраченные нейроны. Кроме того, исследования показали что через приживлеие структур, полученные из стволовых клеток, возможна регенерация мочевого пузыря крыс с сохранением функции, и, что очень важно, - без достоверно установленной реакции отторжения . Эти исследования дали многообещающие результаты в отношении клинического использования эмбриональных стволовых клеток, начиная от регенерации нервной ткани и дальше. Человеческие эмбриональные зародышевые клетки наиболее привлекательны, поскольку они не имеют такого недостатка, как склонность к формированию тератомы на месте инъекции, что было характерно для клеток мышей. их путь дифференциации более длительный, это играет благотворную роль в маскировке и делает их более предсказуемыми для клинического использования. До того, как регенеративная медицина с использованием стволовых клеток будет применима к пациентам, должно быть проведено множество исследований. Многое предстоит узнать о дифференциации эмбриональных зародышевых клеток, чтобы сделать их более доступными в медицинском отношении.
Обновление ооцитов
Широко распространена теория о том, что самки большинства млекопитающих теряют способность к пополнению популяции ооцитов еще в период внутриутробного развития. То есть, в отличие от мужских особей, женские особи рождаются с уже окончательным числом ооцитов, которые в конце концов израсходуются, что приведет к менопаузе. Однако, в противовес этому длительно существующему мнению, было отмечено, что оогенез с продукцией новых ооцитов, возможен и во взрослом периоде. Это было продемонстрировано на случае, когда привитые стволовые клетки сделали возможным пополнение популяции ооцитов у самок зрелых мышей. Более того, это доказывает то, что возможно нахождение стволовых клеток в костном мозге и периферической крови самок млекопитающих животных. Однако следует выяснить, способны ли эти ооциты, полученные из стволовых клеток, к оплодотворению, эмбриональному развитию и созданию жизнеспособного потомства.
Стволовые клетки и тканевой инжениринг
Постоянная нехватка донорских органов и тканей для трансплантации диктует необходимость интенсивных исследований в направлении тканевой инженерии.
Тканевая инженерия - это использование комбинаций клеток строительного материала и соответствующих биохимических факторов для совершенствовании или восстановления биологических функций.
Определение. Первое определение тканевой инженерии было дано Кангером и Вакантом и звучало оно следующим образом: тканевая инженерия- это междисциплинарное направление, которое включает принципы инженерии и естественные науки в соответствии с развитием биологических заменителей, которые восстанавливают, поддерживают, или совершенствуют функции ткани или целого органа.
Мак-Артур и Ореффо дали следующее определение: "Понимание принципов тканевого роста и применение функциональной замены тканей для клинических исследований"
Основное предположение тканевой инженерии - то, что испрльзование естественной биологической системы послужит грандиозному успеху в развитии терапевтических стратегий, направленных на замену, восстановление, поддержание и или улучшении тканевых функций.
Пока полуофициальное определение тканевой инженерии находит широкое применение, на практике термин означает замену или восстановление функции тканей (кости, кровеносные сосуды, суставы, мочевой пузырь и т.д.). Эти ткани имеют преимущество за счет своих механических свойств. Тесно связанное направление - трансплантация клеток, несущих специфические биохимические функции (искусственная поджелудочная железа, искусственная печень).
Термин "регенеративная медицина" часто применяется как синоним к тканевой инженерии, хотя в регенеративной медицине больший акцент приходится на использование стволовых клеток для получения тканей. Тканевая инженерия охватывает и проблему использования живых клеток как строительного материала. Это, в частности, клетки кожи, содержащие живые фибробласты. Суставы восстанавливаются благодаря живым хондроцитам.
Клетки стали доступными как строительный материал, когда в 1990 ученые Герон Кори выяснил как расширить теломеры, образующие бессмертную линию клеток. До этого здоровые культуры нераковых клеток млекопитающих делились лишь фиксированное количество раз до предела Гейфлика. Из жидких тканей, таких как кровь клетки извлекались объемными методами - электрофорезом или аферезом. Из твердых тканей извлечение клеток более затруднительно. Ткань измельчается, а затем расщепляется трипсином или коллагеназой, чтобы удалить внеклеточный матрикс, содержащий клетки. После этого свободно плавающие клетки измельчаются центрифугой или аферезом. Расщепление трипсином в значительной мере зависит от температуры. Высокие температуры расщепляют матрикс быстрее, но создают большую опасность. Коллагеназа менее зависима от температуры и вызывает меньшее повреждение клеток, процесс протекает медленнее и требует дорогих реагентов.
