
- •1.Механикалық қозғалыс.Механикалық жүйе.Механиканың негізгі моделі:материалдық нүкте,қатты дене,тұтас орта.
- •2.Механиканың негізгі ұғымдары:радиус-вектор, траектория, орын ауыстыру, жол.
- •3.Механиканың негізгі ұғымдары: жылдамдық, орташа жəне лездік жылдамдық.
- •4. Материалық нүктенің қозғалыс теңдеуі: бірқалыпты түзу сызықты қозғалыс.Жылдамдықтарды қосудың классикалық заңы.
- •6. Үдеу.Үдеудің нормал жəне тангенциал құраушылары. Толық үдеу.
- •7. Қисық сызықты қозғалыстағы жылдамдық жəне үдеу.
- •8. Айналмалы қозғалыс. Бұрыштық жылдамдық жəне бұрыштық үдеу.
- •9. Механикадағы күштер: ауырлық күші жəне дененің салмағы.
- •13.Ньютонның заңдары.
- •15. Қозғалмайтын оське қатысты қатты дененің айналмалы қозғалыс динамикасының негізгі теңдеуі. Штейнер формуласы.
- •17.Механикалық жұмыс және қуат
- •20.Ламинарлық және турбуленттік ағыс. Үзіліссіздік теңдеуі. Бернулли теңдеуі.
- •22.Механикалық тербелістер. Математикалық маятник.
- •23.Серіппелі маятник.Физикалық маятник.
- •24. Еркін гармониялық тербелістер. Гармониялық тербелістің қозғалыс теңдеуі.Гармоникалық тербелістерді қосу.
- •25. Еріксіз тербелістер, амплитудасы жəне тербеліс фазасы. Механиканикалық
- •26. Толқындар. Толқынның түрлері. Толқындардың негізгі сипаттамалары. Допплер эффектісі
- •30. Адиабаталық процесс. Пуассон теңдеуі
- •31.Идеал газ. Идеал газ күйінің теңдеуі .
- •32.Iшкi энергия. Термодинамикалық жұмыс және Жылу мөлшерi
- •33.Термодинамиканың бірінші бастамасы
- •34.Изопроцесстер және олардың графиктері
- •35. Идеал газдың жылусыйымдылығы.
- •36. .Пайдалы әсер коеффициенті.Термодинамиканың екінші бастамасы.
- •37. Тасымал құбылыстары.Жылу өткізгіштік.
- •38.Нақты(реал) газдар.Ван-дер-Валльс теңдеуі.
- •40.Электр заряды.Электр зарядының сақталу заңы. Кулон заңы.Электр өрісі.
- •42. Электр өрісіндегі өткізгіштер. Электр сыйымдылық. Конденсаторларды
- •44.Тұрақты электр тоғы. Тізбек бөлігіне арналған Ом заңы.Толық тізбекке арналған Ом заңы. Электр қозғаушы күш.
- •45. Джоуль-Ленц заңы. Тоқтың жұмысы мен қуаты
- •46. Металдардағы электр тоғы.
- •47. . Электролиттердегі электр тогы. Фарадейдің электролиз заңы.
- •48. Газдардағы жəне плазмадағы электр тоғы. Плазма туралы түсінік.
- •50. Тізбектің тармақталуы Кирхгоф заңы.
- •52.Электромагниттік индукция. Өздік индукция құбылысы. Индуктивтік. Өзара индукция.
- •54. Заттардағы магнит өрісі. Магнетиктер түрі. Кюри температурасы.
- •56.Дыбыстық толқындар.Радиобайланыс принципі.Радиолокация.
- •63.Абсолют қара дененің сəуле шығару заңдары.
- •64.Фотоэлектрлік эффект. Комптон эффектісі
- •65. Атомдық спектрлердегі заңдылықтар. Атом құрылысы..Бор қағидалары
- •66. Резерфорд тәжірибесі
- •67. Ядролық Күштер
- •69. Табиғи және жасанды радиоактивтік. Радиоактивтік ыдырау заңы
- •70. Ядролық реакциялар
30. Адиабаталық процесс. Пуассон теңдеуі
Сыртқы ортамен жылу алмасусыз өтетін процесс адиабаталық процесс деп аталады. Адиабаталық прцесс кезінде идеал газдың параметрлерін байланыстырып тұратын теңдеуді табайық. Термодиеамиканың бірінші бастамасының теңдеуіне идеал газ үшін dU өрнегін қоямыз:
d´Q vdT+pdV
vdT+pdV
Адиабаталық
процесс үшін d´ Q
 болғандықтан,
болғандықтан,
 vdT+pdV=0
(1)
vdT+pdV=0
(1)
Шарты орындалуы тиіс.
Енді p-ні идеал газдың күй теңдеуіне сәйкес V және Т арқылы анықтаймыз:
P=
Мұны
(1) –ге қоямыз. Нәтижесінде нольден
ерекше
 көбейткішіне қысқартып, мынаны аламыз:
көбейткішіне қысқартып, мынаны аламыз:
 vdT+
vdT+
Алынған өрнекті былайша түрлендіреміз:

Соңғы қатынасты
d(lnT+
түрінде жазуға болады, осыдан адиабаталық процесс кезінде
lnT+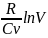 =const
(2)
=const
(2)
екендігі шығады.
Идеал газ үшін Ср – Сv= Rекендігін ескерсек, R/Cv қатынасын γ – 1-мен алмастыруға болады, мұндағы γ=Cp/v . (2) – де осындай түрлендіру жүргізіп және алынған шаманы потенцирлеп,
ТVγ-1= const (3)
теңдеуіне келеміз. Табылған қатыс Т және V айнымалыларда идеал газдың адиабаталық теңдеуі болып табылады.Бұл теңдеуден идеал газдың теңдеуіне сәйкес Т-ні Р және V арқылы өрнектеп, р және V айнымалылары арқылы жазылған теңдеуге өтуге болады:
T=
Т-нің мәнін (3)- ке қойып және р және V шамаларының тұрақты екенін ескере отырып, мынаны аламыз: р Vγ=const-1 (4)
(4) қатысы р және V айнымалылары арқылы жазылған идеал газ адиабатасының теңдпеуі болып табылады. Оны Пуассон теңдеуі деп те атайды.
Адиабатаның
(4) теңдеуін изотерманың теңдеуімен
салыстырудан адиабатаның изотермаға
қарағанда тезірек өтетінін көреміз.
Изотерма мен адиабата үшін
 – ның бір ғана (р,
– ның бір ғана (р, )
нүктедегі мәнін есептеп шығарайық.
)
нүктедегі мәнін есептеп шығарайық.
Формуланы дифференциалдасақмына теңдеуді аламыз:
pdV + Vdp= 0
Осыдан изотерма үшін мынаны аламыз:
 .
.
(4) – ті дифференциалдасақ былай болады:
pγVγ-1dV+ Vγdp=0

Cонымен, адиобатаның көлбеу бұрышының тангенсі изотерманікінен γ есе артық болады екен.
Жоғарыда барлық уақыттарда да, газдың күйі әрбір мезетінде р және Т параметрлерінің белгілі мәндерімен сипатталады, яғни, басқа сөзбен айтқанда, қарастырылып отырған адиабаталық процесс тепе-теңдікте өтеді деп ұйғардық.Біз білетіндей, тек өте баяу өтетін процесс қана тепе-теңдіктегі процесс бола алады. Сонымен қатар табиғатта жылуды мүлдем өткізбейтін заттар болмайтындықтан, процесс неғұрлым аз уақытқа созылса, системның қоршаған ортамен алмасатын жылу мөлшері адиабаталық процесске жуық болады. Мұндай прцестің мысалына дыбыс толқыны таралған газдың әрбір нүктедегі сығылуы мен ұлғаюы жатады.Үлкен көлемнің шегінде бұл кездегі газ күйін тепе-теңдікте әрбір мейлінше аз көлем үшін газ күйі (4) адиабата теңдеуін толық қанағаттандырады.
31.Идеал газ. Идеал газ күйінің теңдеуі .
Идеал газ деп молекулалар арасында өзара əсерлесу күштрі болмайтын,жеке молекулалар көлемі ыдыс көлемімен салыстырғанда өте аз жəне малекулалар арасындағы өзара соқтығысуы абсолют серпімді болатын газды айтады. Көптеген тəжірибелер бойынша қалыпты жағдайда (оттек,гелий), яғни төменгі қысымда жəне жоғарғы температурада нақты газдар қасиеті идел газ
қасиетіне сəйкес келеді.Молекула-кинетикалық теория ашылғанға дейін идеал газдар қасиетін сипаттайтын көптеген заңдылықтар болған.Бойль-Мариотт заңы. Газ күйіндегі заттардың меншікті көлемі болмайды.
Сондықтан газдар ыдысқа толтырылғанда, сол ыдыстың көлемін толық алып тұрады жəне ыдыс қабырғаларына белгілі бір қысым күшін түсіреді. XVII ғасырдың ортасында ағылшын ғалымы Р.Бойль (1627-1691) жəне француз физигі З.Мариотт (1620-1684) бір-біріне тəуелсіз жасалған тəжірибе қорытындыларынан,
температура тұрақты болғанда газ көлемінің (v) оның қысымына (p) тəуелді өзгеретінің тұжырымдады, яғни берілген газ массасы үшін тұрақты температурада оның қысымы көлеміне кері пропорционал өзгереді, яғни
PV=
const ,
 =
= (1)
(1)
Бұл тəуелділікті изотерма деп аталатын гипербола қисығымен көрсетуге.
Газ күйінің бір күйден екінші күйге тұрақты температурада өтуі изотермиялық процес деп аталады. Ал нақты газдар бұл заңдылыққа тек тығыздықтары өте аз болғанда ғана бағынады. Сонымен,тұрақты температурада Р мен V тəуелділігі заттар қасиетін сипаттайды. Гей-Люссак заңы. Газ көлемінің (V) оның температурасына (Т) тұрақты.
қысымда (р=const) тəуелді болу шартын бірінші рет француз ғалымы Гей-Люссак (1778-1850) тағайындады: берілген газ массасы үшін қысымы тұрақты болғанда,газ көлемі оның температурасына сызықты тəуелді өзгереді (p=const, m=const) V= 0 V (1+ α v t°) (2 )
Мұндағы c V – газдың 00C – тағы көлемі, V α – газдың көлемдік ұлғаюының термиялық коэффициенті. Тұрақтық қысымда газ көлемі мен температура тəуелділігі гракфикте түзу сызықпен көрсетіледі. Қысымның əрбір мəніне сəйкес келетін түзу сызық изобара деп аталады. Ал газ күйінің тұрақты қысымда өзгеруі изобаралық процесс делінеді.Шарль заңы. Тұрақты көлемде газ температурасының қысымға тəуелді болатыны да анықталады,яғни белгілі газдың массасы үшін көлемі тұрақты болғанда, газ қысымы оның температурасына сызықты тəуелділікке өзгеріледі(V=const. m=const)
Ρ = Ρ0 (1+αPt0) (3)
мұндағы Ρ- газдың 00C – тағы қысымы, ρ α - газ қысымының термиялық коэффициенті. Көлем тұрақты болғанда, Ρ мен t тəуелділігі түзу сызықты жəне ол изохора деп аталады(3-сурет). газ күйінің мұндай өзгеруі изохоралық процесс дейді. Зерттеудің нəтижелері газдардың термиялық коэффициенттері V α жəне ρ α бір-біріне шамалас екенін көрсетеді, яғни
αʋ=αp
= α= -1
-1
Изобара
жəне изохора түзулері абсцисса өсінде
шамасы t0= нүктесінде қиылысады. Температурасыны
бастапқы санау нүктесін осы нүктеге
ауыстырып, температурасының Цельсии
шкаласынан абсолют кельвин шкаласы
деп аталатын басқа температуралық
шкалаға өтуге болады. Бірліктердің
халық аралық жүйесінде Кельвин –
температурасының термодинамикалық
шкаласында негізгі өлшем болып, су
күйінің үштік нүктесіне сəкес келетін
термодинамикалық температураның
I/273,15 нлесіне тең болады.
нүктесінде қиылысады. Температурасыны
бастапқы санау нүктесін осы нүктеге
ауыстырып, температурасының Цельсии
шкаласынан абсолют кельвин шкаласы
деп аталатын басқа температуралық
шкалаға өтуге болады. Бірліктердің
халық аралық жүйесінде Кельвин –
температурасының термодинамикалық
шкаласында негізгі өлшем болып, су
күйінің үштік нүктесіне сəкес келетін
термодинамикалық температураның
I/273,15 нлесіне тең болады.
Абсолют температура Т мен Цельсии бойынша анықталған t температурасының арасында мынандай қатынас болады. Мысалы, 00C -қа + 273,15 К сəкес келеді. 00 K –қа тең температура абсолют нөл деп аталады, оған − 273.150C мəні сəйкес келеді. Енді (2) жəне (3) теңдеулерге абсолют температураның мəнің қойып, оны басқа түрде жазуға болады
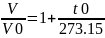 немесе
немесе

Бұдан
Егер 0 T мен 0 V тұрақты шама екенін ескерсек, онда изобаралық процесс үшін:
(4)
Осындай əдіспен изохоралық процесс үшін де мынадай теңдікті жазуға болды, яғни
 (5)
(5)
Авогадро тағайындаған заң бойынша бірдей жағдайларда, яғни бірдей
температура мен қысымда барлық газдардың модельдерінің көлемі бірдей болады.Қалыпты жағдайда:Ρ =1,013 *105 Па ; Т=273,15К болса, оның көлемі
V = 22,41*10−3 м3 / моль − ге тең
Əр түрлі заттарындың бір мольдегі молекулалар саны бірдей
болады: N = 6,022 *1023 моль−1 A , бұл Авагадро саны деп аталады.
Ағылшын физигі жəне химигі Дж.Дальтон (1766-1844) тағайыңдаған заң бойынша,
идеал газдар қоспасының жалпы қысымы,сол қоспаны құрайтын газдардың парциал қысымдарының қосындысына тең болады, яғни
Ρ = 1 Ρ + 2 Ρ + 3 Ρ + … + n Ρ (6)
Мұндағы 1 Ρ + 2 Ρ + 3 Ρ + ⋅⋅⋅ + n Ρ -парциал қысымдар. Сонымен идеал газдың берілген массасы үшін (m=const) жоғарыда қарастырылған
заңдылықтар, яғни :ΡV =const (изотермиялық процесс), V /T =const (изобаралық процесс), P/T=const (изохоралық процесс) дұрыс екен.
