
- •Расчётно-пояснительная записка к курсовой работе на тему:
- •3. Выбор принципа работы автоматизированного иммунологического экспресс анализатора.
- •3.1 Общие принципы анализа
- •3.2 Реакция конкурентного типа
- •3.3 Реакция «сэндвич» типа
- •3.2 Методы анализа
- •3.2.2 Пластиковый шарик
- •3.2.3 Парамагнитные частицы
- •3.2.6 Риф, фпиа
- •3.3 Сравнение методов анализа
- •Заключение
- •Список использованых источников
3.2 Методы анализа
Исходя из вышеизложенных общих принципов реакции можно выделить следующие иммунохимические методы:
1. По типу метки:
РИА (радиоизотопный иммуноанализ)
ИФА (иммуноферментный анализ)
РИФ (реакция иммунофлюоресценции) и ФПИА (поляризационный флюоресцентный иммуноанализ)
ИХЛА (иммунохемилюменисцентный анализ)
2. По типу твердой фазы
Coaled Tube (пробирки, покрытые слоем абсорбированных антител)
Пластиковый шарик
Парамагнитные частицы
Сначала рассмотрим более подробно преимущества и недостатки использования различных типов твердофазной сепарации.
Прежде всего опишем основные требования, которыми должна обладать твердофазная часть реактива.
Обеспечение большой реакционной площади.
Низкое время диффузии молекул реакционных компонент
Удобство использования реактива
Низкая стоимость производства
Возможность создания анализаторов, удовлетворяющих современным требованиям.
3.2.1 Coated Tube
В процессе производства или непосредственно перед проведением реакции AT адсорбируются на стенке реакционной кюветы (пробирки, плашки), что удерживает их в процессе промывки в кювете. Основные недостатки: малая площадь реакции, долгое время диффузии, а значит и реакции, так как реакция идет только в пристеночном слое. Кроме того, кювета становится реактивом, что повышает требования к ее хранению. Автоматизация процесса практически невозможна.
Достоинства: готовый к использованию, дешевый реактив.
Используется в основном в плашечных анализаторах (ручные и полуавтоматические методики).
Применение в анализаторах: автомат серийного типа с ограниченной возможностью свободного доступа AutoDelfia (Wallac), автомат Eci (Johnson & Johnson).
3.2.2 Пластиковый шарик
Является следующим шагом в развитии технологии. AT адсорбированы на пористой поверхности пластикового шарика, что увеличивает площадь реакции и снижает ее продолжительность, так как возможно использование перемешивания и оно более эффективно, чем в предыдущем случае.
Основные достоинства: повышение скорости реакции по сравнению с предыдущей технологией, возможность использования любых кювет для реакции, возможность автоматизации
Недостатки: для увеличения площади реакции требуется увеличивать размер шарика, что ведет к большим габаритам емкости для хранения реактива, недостаточная скорость реакции.
Применение в анализаторах: Cobas Core II (La Roche); Immulite, Immulite 2000 (DPC).
3.2.3 Парамагнитные частицы
AT связаны ковалентно с мелкодисперсными парамагнитными частицами, которые образуют взвесь в реакционной смеси, что превращает реакцию в объемную из поверхностной, как было в предыдущих технологиях и значительно повышает скорость реакции. Сепарация осуществляется за счет магнитов, которые включаются на время промывки, и притягивают связанные с парамагнитными частицами иммунные комплексы.
Основные достоинства: самое короткое время реакции, наиболее технологичный для автоматизации реактив.
Недостаток необходимо постоянно поддерживать частицы реактива во взвешенном состоянии, как во время реакции, так и при дозировке реактива.
Применение в анализаторах: Elecsys 1010, 2010 (La Roche); ACS:180, ACS:Centaur (Chiron Diagnostics); AxSym (Abbot); Eci (Johnson & Johnson).
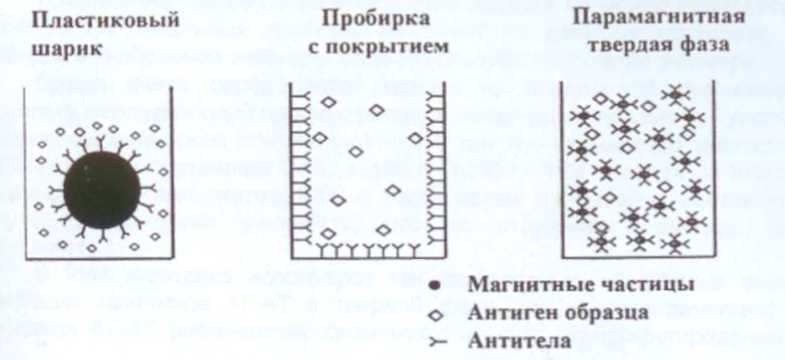
Рисунок 7. Работа парамагнитных частиц.
3.2.4 РИА
Метод основан на использовании радиоактивных веществ в качестве метки. На практике чаще всего используют изотоп I12553. Распад I125 идет по схеме γ-распада I12553 → I12552 + hν (35 keV), где hν - фотон указанной энергии. Период полураспада I12553, составляет Т1/2=60,14 суток или 1443,36 ч, постоянная распада λ=8*10 мин', т.е. за 1 минуту распадается 0,0008 % имеющегося радиоактивного вещества. Для определения количества распадов используют γ -счетчики. Схема работы их представлена ниже.
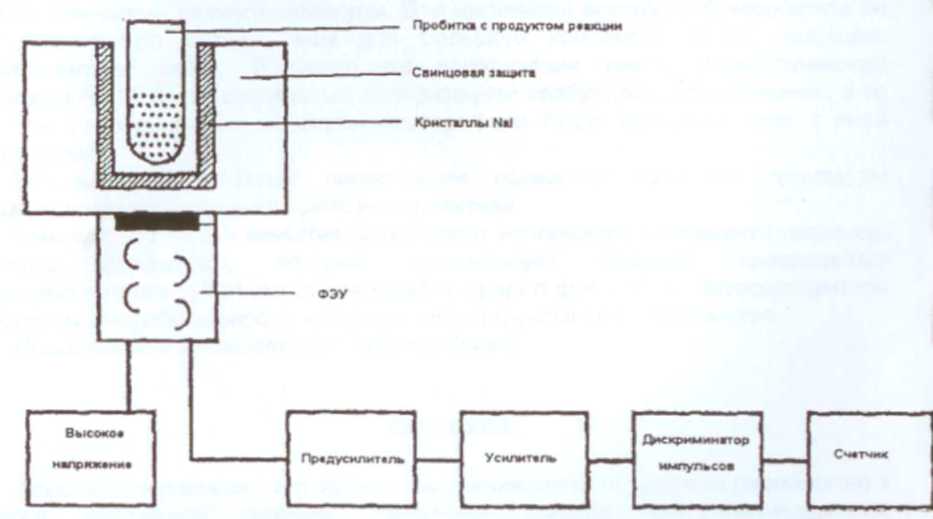
Рисунок 8. Схема работы РИА.
Распады, происходящие в образце, регистрируются с помощью кристаллов NaI, которые преобразуют γ -излучение в световое с длиной волны 420 нм. Световые вспышки регистрируются фотоэлектронным умножителем (ФЭУ), сигнал которого усиливается импульсным усилителем, обрабатывается на дискриминаторе, выделяющим импульсы требуемой высоты (длительности) и подсчитывается на счетчике. Выходным параметром измерительной системы является количество счетов в минуту, которое пропорционально количеству распадов в минуту (эффективность счетчиков около 75 %, т.е. 75 % распадов фиксируется ФЭУ).
Приведенная выше схема достаточно общая и ее можно использовать только теоретически. Реальные приборы работают по данному принципу, но вместо пробирок и П-образной γ -камеры чаще используют проточную γ -камеру.
Время счета определяется исходя из предельной погрешности счета. Поскольку вероятностный процесс распада имеет распределение Пуассона, то СКО (среднеквадратическое отклонение) ̴ √N, где N - количество распадов. Так для N=1000 ошибка составляет 3 %, а для N=10000 - 1 %. Исходя из этого выбирают среднее количество счетов 1000 и тогда время считывания составляет около 1 минуты. Необходимо учитывать, что со старением реактива погрешность возрастает.
В РИА методике используют как стандартные, описанные выше, методы сепарации комплекса АГ-АТ в твердой фазе, так и специфические: осаждение комплекса АГ-АТ (химическое, физическое за счет центрифугирования, иммунное (антитело связывается со специальным антителом, осаждающим комплекс или способствующим осаждению)).
РИА метод является первым методом иммунохимии, на котором отрабатывались все методики, существующие в настоящее время. Сейчас он утратил свою актуальность, благодаря появлению методов с нерадиоактивными метками (см. ниже), которые обеспечивают такую же или более высокую чувствительность, но, не являясь экологически и биологически опасными, позволяют автоматизировать процесс и имеют более длительные сроки хранения реактивов. В современных лабораториях РИА метод используется в ряде случаев как референтный для других методов иммунохимии, а в нашей стране применяется в рутинной работе для определения тех веществ, которые отсутствуют в стандартных коммерческих наборах. Вследствие того, что метод РИА ручной, низкопроизводительный и трудоемкий, он повсеместно замещается другими методиками.
3.2.5 ИФА
В ИФА может использоваться не менее 15 различных ферментов.
Ферментные метки обладают чрезвычайно мощным каталитическим действием, одна молекула фермента может реагировать с большим количеством молекул субстрата. Таким образом, фермент, присутствующий в ничтожных количествах, можно выявить и количественно определить по образованию продуктов, катализируемой им реакции. Другое преимущество применения ферментов в качестве меток обусловлено наличием в молекуле многочисленных функциональных групп (сульфгидрильных, карбоксильных, остатков тиразина и др.), через которые можно ковалентно присоединить молекулы лиганда.
Ферментные маркеры, используемые в ИФА, должны обладать следующими свойствами:
высокая активность и стабильность фермента в условиях анализа, при модификации и в конъюгате с антителами или другими белками;
наличие чувствительных субстратов и простота метода определения продуктов или субстратов ферментативной реакции;
возможность адаптации субстратных систем к дальнейшему усилению;
отсутствие фермента и его ингибиторов в исследуемой биологической жидкости.
Наибольшее применение нашли пероксидаза хрена (ПХ), щелочная фосфотаза (ЩФ) и β-D-галактозидаза. Все три стабильны и катализируют высокочувствительные реакции. Кроме того, продукты, получаемые в результате реакций, катализируемых этими ферментами, в зависимости от используемого субстрата, могут выявляться не только колориметрическими методами, но также флуоресцентными методами. Другие ферменты используются значительно реже. Это объясняется их более низкой в сравнении с ПХ и ЩФ удельной активностью.
После проведения основной реакции АГ-АТ и сепарации продукта реакции, к нему добавляется избыток субстрата. Выбор субстрата в первую очередь определяется используемым в качестве метки ферментом, так как реакция фермент-субстрат высоко специфична.
Основные требования к субстрату:
обеспечение высокой чувствительности метода при выявлении фермента в конъюгате;
образование хорошо учитываемых (например, окрашенных) продуктов реакции фермент-субстрат;
субстрат должен быть безопасным, дешевым, доступным и удобным для применения.
Чаще используют хромогенные субстраты, которые, разрушаясь, образуют окрашенное вещество. Перспективным является использование высокоэнергетических субстратов – флуоресцентных, хемипюминесцентных. Применение таких субстратов позволяет теоретически повысить чувствительность ИФА на два порядка.
В результате реакции, катализируемой ферментом, интенсивность окраски раствора изменяется, что регистрируется с использованием спектрофотометра. Поскольку изменение интенсивности окраски пропорционально количеству продукта ферментной реакции, которое в свою очередь зависит от количества фермента, то оно (изменение) пропорционально количеству АГ в измеряемой пробе.
При применении данного метода прибор калибруется с использованием нескольких стандартов (обычно 6-10), представляющих собой образцы сыворотки с точно известной концентрацией искомого АГ. При их анализе прибор строит для себя нелинейную кривую соответствия «определяемый параметр - измеряемая величина (ток)», которая в дальнейшем может быть линеаризована с помощью различных математических преобразований (logit, loglin и т.д.). В дальнейшем данная кривая используется для пересчета измеренной величины (тока) в концентрацию измеряемого вещества.
Периодичность рекалибровки составляет в среднем 7-14 дней.
Применение в анализаторах: Cobas Core II (La Roche), ES 300 (Behringer Manhaim).
