
- •3. Фізичні властивості чистої води
- •3.1. Залежність густини від температури
- •3.2. Поверхневий натяг
- •3.3. Властивість розчиняти речовини
- •4. Практична частина
- •4.1. Залежність поверхневого натягу від температури, домішок та густини
- •4.2. Розрахунок роботи поверхневих сил при утворенні бульбашки
- •5. Водні ресурси України
- •Висновки
ГОЛОВНЕ УПРАВЛІННЯ ОСВІТИ І НАУКИ
ВИКОНАВЧОГО ОРГАНУ КИЇВСЬКОЇ МІСЬКОЇ РАДИ
(КИЇВСЬКОЇ МІСЬКОЇ ДЕРЖАВНОЇ АДМІНІСТРАЦІЇ)
КИЇВСЬКИЙ ПАЛАЦ ДІТЕЙ ТА ЮНАЦТВА
КИЇВСЬКЕ ТЕРИТОРІАЛЬНЕ ВІДДІЛЕННЯ МАН УКРАЇНИ
(КИЇВСЬКИЙ МАН «ДОСЛІДНИК»)
Секція : фізика
Тема роботи : Фізичні властивості води
Автор роботи:
Сидорчук Ірина Володимирівна
учениця 9-Є класу гімназії № 315
Дарницького р-ну м. Києва
Домашня адреса:
м. Київ, вул. Драгоманова, 40, кв. 98
контактний тел.: 570-02-64
Педагогічний керівник :
Максимова Наталія Михайлівна
Київ - 2006
ЗМІСТ
Вступ
2.1. Вода – рідина 2.2. Така непроста молекула
3.1. Залежність густини від температури 3.2. Поверхневий натяг 3.3. Властивості розчиняти речовини
4.1. Залежність поверхневого натягу від температури, домішок та густини 4.2. Розрахунок роботи поверхневих сил при утворенні бульбашки
Висновок Список використаної літератури |
3 4 5 5 8 13 13 14 14 15 16
17
19 22 23 |
Вступ
То луга ли, скажи, облака ли, вода ль Околдована желтой луною: Серебристая гладь, серебристая даль Надо мной, предо мною, за мною...
Інокентій Анненський
 В
даній роботі мова йтиме про воду,
здавалося б, усім добре відому, але
насправді про ще досить невідому і
принципово нову. Про воду пишуть багато.
Пишуть вчені різних спеціальностей:
фізики, хіміки, геологи, біологи,
астрономи, і пишуть вже багато століть.
В
даній роботі мова йтиме про воду,
здавалося б, усім добре відому, але
насправді про ще досить невідому і
принципово нову. Про воду пишуть багато.
Пишуть вчені різних спеціальностей:
фізики, хіміки, геологи, біологи,
астрономи, і пишуть вже багато століть.
Сучасна наука лише приступила до досліджень біофізичних властивостей води. Нове сторіччя, скоріш за все, пройде під знаком вивчення властивостей і особливостей води в живих об'єктах. В даний час вже отримана велика кількість експериментальних даних, що стосується взаємодії води і біологічних об’єктів .
Робота присвячена дослідженню деяких властивостей води. В повсякденному житті користуючись водою і водневими розчинами ми не завжди звертаємо увагу на унікальність цієї речовини. Мене зацікавило: чому деякі предмети можуть утримуватися на поверхні води; чому рідина завжди набуває форму бульбашки; чому при взаємодії з різним покриттям поверхня води приймає різну форму; чому різні розчини води мають неоднакові властивості. Для того, щоб знайти відповіді на ці питання, я опрацювала велику кількість різноманітної літератури та провела деякі досліди.
1. Життя — це вода
Відкриття кожної нової якості та особливості води вражає і хвилює уяву і, здається, у своїй загадковості вода невичерпна.
Якщо не зважати на її
фундаментальні біофізичні властивості,
що будуть обговорюватися далі, звертає
на себе увагу вже той безперечний факт,
що навіть кількісно вода домінує в
біосфері.
Біосфера, що включає
в сю
сукупність живих організмів і ту частину
речовини планети, що знаходиться в
безупинному обміні з цими організмами,
мізерно тонка - від глибин океанських
западин до висот сніжних вершин шар
біосфери досягає товщини всього 20 км,
що складає лише 0,3 %
радіуса Землі. До того
ж ця обітована плівка на поверхні Землі
в основному водяна, і в цьому розумінні
наша планета є планетою
ВОДИ. В таких умовах
очікувати (і це цілком доречно), що вода
відіграє певну функціональну роль у
життєдіяльності організмів.
сю
сукупність живих організмів і ту частину
речовини планети, що знаходиться в
безупинному обміні з цими організмами,
мізерно тонка - від глибин океанських
западин до висот сніжних вершин шар
біосфери досягає товщини всього 20 км,
що складає лише 0,3 %
радіуса Землі. До того
ж ця обітована плівка на поверхні Землі
в основному водяна, і в цьому розумінні
наша планета є планетою
ВОДИ. В таких умовах
очікувати (і це цілком доречно), що вода
відіграє певну функціональну роль у
життєдіяльності організмів.
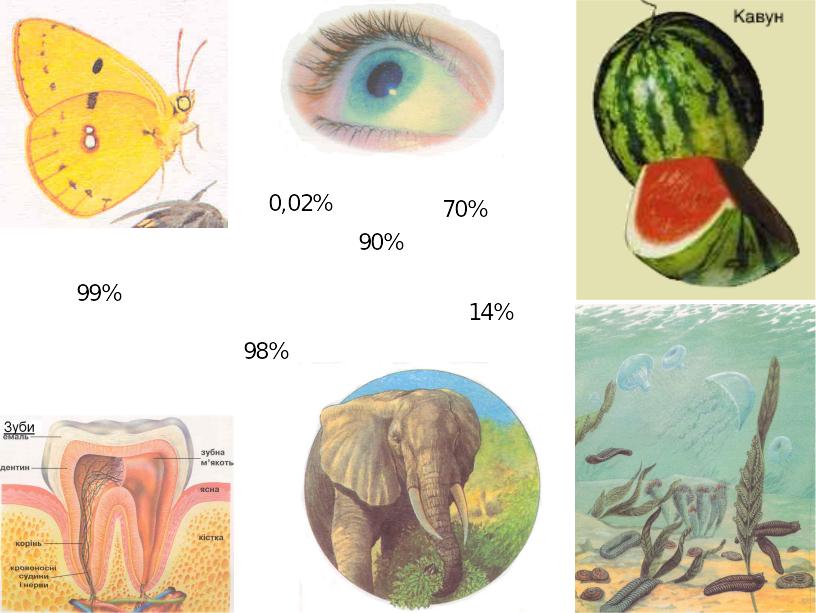 3/4 поверхні
Землі покриті водою, а живі організми
- від людини до медузи й амеби - містять
по масі в середньому від 65 до 98 % води.
Наприклад, 4-місячний ембріон людини
містить приблизно 92 % води, немовлята -
до 72 %, дорослі - 60
- 65 %, мозок - 75 %, кров - 83 %, легені і серце
- 79 %, печінка - 68 %, нирки
- 83 %, м'яз - 75 %, кишки - 74,5%, шкіра – 72%,
кістки - 22 %, жир - 10 % води [12].
3/4 поверхні
Землі покриті водою, а живі організми
- від людини до медузи й амеби - містять
по масі в середньому від 65 до 98 % води.
Наприклад, 4-місячний ембріон людини
містить приблизно 92 % води, немовлята -
до 72 %, дорослі - 60
- 65 %, мозок - 75 %, кров - 83 %, легені і серце
- 79 %, печінка - 68 %, нирки
- 83 %, м'яз - 75 %, кишки - 74,5%, шкіра – 72%,
кістки - 22 %, жир - 10 % води [12].
2. Незвичайні властивості води
Розглянемо спочатку особливі властивості води, а також з'ясуємо, чим саме вода «ненормальна» і що б відбулося, якби раптом вона стала «нормальною» рідиною.
А номальні
властивості води настільки буденні і
природні, що звичайно ми і не підозрюємо
про їхнє існування, зовсім забувши, що
ці властивості - подарунок природи
всьому живому на Землі. Коли ми п'ємо
воду чи заливаємо її в радіатор автомобіля,
хіба нам прийде в голову подякувати
природу за аномальність властивостей
води?
номальні
властивості води настільки буденні і
природні, що звичайно ми і не підозрюємо
про їхнє існування, зовсім забувши, що
ці властивості - подарунок природи
всьому живому на Землі. Коли ми п'ємо
воду чи заливаємо її в радіатор автомобіля,
хіба нам прийде в голову подякувати
природу за аномальність властивостей
води?
2.1. Вода – рідина
Саме дивна і милостива для живої природи властивість води - це її здатність при нормальних умовах бути рідиною. Молекули дуже схожих на воду з'єднань (наприклад, молекули Н2S чи Н2Sе) набагато важчі, а утворюють при тих же умовах газ. Тим самим вода начебто суперечить закономірностям таблиці Менделєєва, що, як відомо, пророкує, коли, де і які властивості речовин будуть близькі.
У нашому
випадку з таблиці Менделєєва випливає,
що властивості водневих з'єднань
елементів (називаних гідридами),
розташованих у тих самих вертикальних
стовпцях, з ростом маси атомів повинні
змінюватися монотонно. Кисень - елемент
шостої групи цієї таблиці. У цій же групі
знаходяться сірка S (з атомною вагою
32), селен Sе (з атомною вагою 78), телур Тe
(з атомною вагою 127) і поллоній Ро (з
атомною вагою 209). Отже, властивості
гідридів цих елементів повинні мінятися
монотонно при переході від важких
елементів до більш легким, тобто в
послідовності Н2Ро![]() H2Te
H2Se
H2S
H2O.
Що і відбувається, але тільки з першими
чотирма гідридами [9].
H2Te
H2Se
H2S
H2O.
Що і відбувається, але тільки з першими
чотирма гідридами [9].
Наприклад, температури кипіння і плавлення зростають при збільшенні атомної ваги елементів. На мал. 2.1 [9] хрестиками позначені температури кипіння цих гідридів, а кружечками — температури плавлення. Як видно, при зменшенні атомної ваги температури знижуються зовсім лінійно. Область існування рідкої фази гідридів стає усе більш «холодною», і якби гідрид кисню Н2О був нормальним з'єднанням, схожим на своїх сусідів по шостій групі, то рідка вода існувала б у діапазоні від - 80° С до - 95° С [4]. При більш високих температурах Н2О завжди була б газом.
,

Мал. 2.1. Залежність температур кипіння ( + ) і плавлення (о) гідридів елементів шостої групи таблиці Менделєєва від атомної ваги.
Не потрібно мати багате уявлення, щоб уявити собі, яким було б життя у присутності такої «нормальної» води. На щастя для нас і всього живого на Землі, вода аномальна, вона не визнає періодичної закономірності, а задовольняє своїм, не цілком ще зрозумілим законом.
«Неправильні» температури плавлення і кипіння не єдина рятівна для нас аномальність води. Життєво важливою для всієї біосфери є здатність води при замерзанні зменшувати, а не збільшувати свою щільність (як це відбувається майже з всіма іншими речовинами). Вперше на цю незвичайну властивість води звернув увагу ще Г.Галілей [4].
С правді,
при переході рідини у твердий стан
правді,
при переході рідини у твердий стан
молекули речовини начебто повинні розташовуватися тісніше, а сама речовина повинна ставати щільніше. Звичайно речовини так і поводяться. Але вода є винятком. Якщо взяти звичайну воду і, поступово охолоджуючи її, стежити за зміною щільності, то можна помітити, що на початку буде відбуватися зовсім звичайний і природний процес - вода стає при охолодженні усе щільніше і щільніше, і ніяких відхилень від норми ми не побачимо доти, поки не остудимо воду до 4° С (мал. 2.2, [4]). Нижче цієї температури всупереч загальним уявленням вода раптом легшає, а, замерзаючи, вона робиться ще легше й утворює кригу, що плаває по поверхні води.
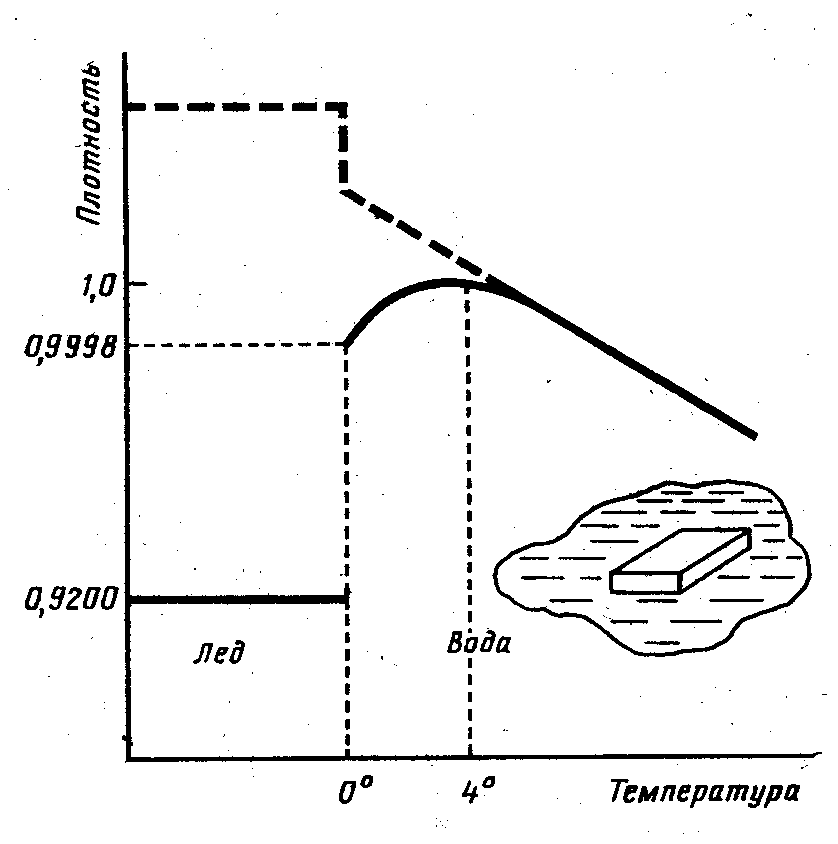
Мал. 2.2. Залежність щільності води від температури. Якби вода була «нормальною» рідиною, то ця залежність мала б вигляд, показаний пунктирною лінією.
Саме ця
особливість води, як відомо, охороняє
від суцільного промерзання в суворі
зими озера і ставки, і тим самим рятує
життя в цих водоймах. Осіннє повітря
прохолоджує поверхневі шари озера, вони
стають важчі й опускаються на дно.  Озеро
прохолоджується. Але цей процес йде
лише доти, поки температура води не
досягне 4° С. Якщо тепер поверхневі шари
стануть ще холодніше, то вони вже не
опускаються на дно, тому що щільність
цих шарів менше щільності глибинної
води, де зберігається температура 4° С.
Відмінності в щільності не великі - як
видно з мал. 3.2, ці відмінності виявляються
лише в четвертому знакові після коми,
- але цих відмінностей цілком достатньо,
щоб вода з температурою, близькою до 0°
С, не могла проникнути в глибину озера.
Процес охолодження поверхневих шарів
піде тепер швидше, і незабаром свинцева
гладь озера закриється першим тендітним
льодом. Крига - поганий провідник тепла,
і він надійно сховає від страшних зимових
морозів життя озера.
Озеро
прохолоджується. Але цей процес йде
лише доти, поки температура води не
досягне 4° С. Якщо тепер поверхневі шари
стануть ще холодніше, то вони вже не
опускаються на дно, тому що щільність
цих шарів менше щільності глибинної
води, де зберігається температура 4° С.
Відмінності в щільності не великі - як
видно з мал. 3.2, ці відмінності виявляються
лише в четвертому знакові після коми,
- але цих відмінностей цілком достатньо,
щоб вода з температурою, близькою до 0°
С, не могла проникнути в глибину озера.
Процес охолодження поверхневих шарів
піде тепер швидше, і незабаром свинцева
гладь озера закриється першим тендітним
льодом. Крига - поганий провідник тепла,
і він надійно сховає від страшних зимових
морозів життя озера.
2.2. Така непроста молекула
Всі аномальні властивості води говорять про те, що молекули Н2О в рідині досить міцно зв'язані між собою і утворюють певну молекулярну конструкцію, що протидіє будь-яким зовнішнім руйнівним впливам: тепловим, електричним, механічним. Тому і потрібно підвести так багато тепла до води, щоб перетворити її на пару, тому така велика питома теплота випару води. Саме ці зв'язки і є ключем до розуміння особливих властивостей води. У 1920 р. американські вчені У. Латимер і В. Родебуш запропонували назвати ці особливі зв'язки водневими [4]. З тих пір це поняття стало хрестоматійним, увійшло в усі підручники і стало предметом серйозних фундаментальних досліджень.
Походження водневого зв'язку обумовлено квантовомеханічними особливостями взаємодії протона з атомами, зокрема, його здатністю до тунелювання у певних умовах. В подальші подробиці вдаватися не варто, просто зафіксуємо, що атом водню, появившись поруч з атомом кисню (чи азоту, фтору, хлору), утворює з ним специфічний порівняно міцний зв'язок [4].
При чому цей зв'язок сильно спрямований. Отже, якщо атом водню знаходиться між двома атомами кисню, то просторова організація такої трійки атомів не може бути довільною, а буде мати зовсім чітку, однозначну структуру.
Інша важлива властивість водневого зв'язку називається кооперативністю й означає, що утворення одного водневого зв'язку сприяє виникненню поруч наступного зв'язку, що, у свою чергу, сприяє утворенню наступного, і т.д. [4]. Фізико-хімічна природа кооперативності полягає в тому, що дві молекули Н2О, утворивши водневий зв'язок, вступають у кислотно-лужну взаємодію, в результаті якої одна молекула стає більш кислою, а інша - більш лужною. Тому для утворення цими ж молекулами й інших водневих зв'язків потрібно менше енергії.
Наявність водневих зв'язків позначається на спектрах - коливальних, електронних і ядерно-магніто-резонансних (ЯМР). Характеристичні частоти коливань груп, що містять водень, знижуються, якщо цей водень входить до складу водневого зв'язку. Інфрачервоні смуги поглинання, наприклад О-Н групи, сильно розширюються при виникненні водневого зв'язку, а їхня інтенсивність збільшується [4]. Енергія водневого зв'язку лежить в інтервалі від 2,3 ккал/моль для N-Н... до 7,0 ккал/моль для фтористого водню F-Н. Оскільки водневий зв'язок завжди утворюється між двома електронегативними атомами, то спочатку вважалося, що енергія водневого зв'язку має суто електростатичну природу. Розрахунок енергії електростатичної взаємодії дає значення, близькі до енергії водневого зв'язку. Однак таке трактування природи водневого зв'язку суперечить спектроскопічним даним [4].
Отже, ключ до розуміння особливих властивостей води і її розчинів лежить у концепції водневого зв'язку. Однак це «необхідна», але не «достатня» умова. Як ми бачили, не тільки молекули води можуть утворювати водневі зв'язки, але і молекули інших речовин, наприклад, аміаку NН3 чи фтористоводородної кислоти НF. Але ні ці, ні які інші речовини не мають весь спектр аномальних властивостей, характерних для води. У чому ж справа? Чому ті самі водневі зв'язки роблять воду аномальною рідиною і лише злегка виділяють аміак з ряду звичайних субстанцій? Щоб відповісти на ці запитання, зробимо наступний крок у пізнанні природи води і розглянемо молекулярну структуру цієї рідини.
Двісті років тому було встановлено [4], що молекула води складається з трьох атомів: атома кисню і двох атомів водню. В наш час витончених фізичних методів досліджень вдалося встановити, що довжина кожного зв'язку О-Н дорівнює 0,99 Ангстрем, а кут між цими зв'язками дорівнює 109,5°. Як бачимо, молекула води досить «однобока» - обидва атоми водню примикають до кисню з однієї сторони (мал. 2.3.а; 2.3.б).
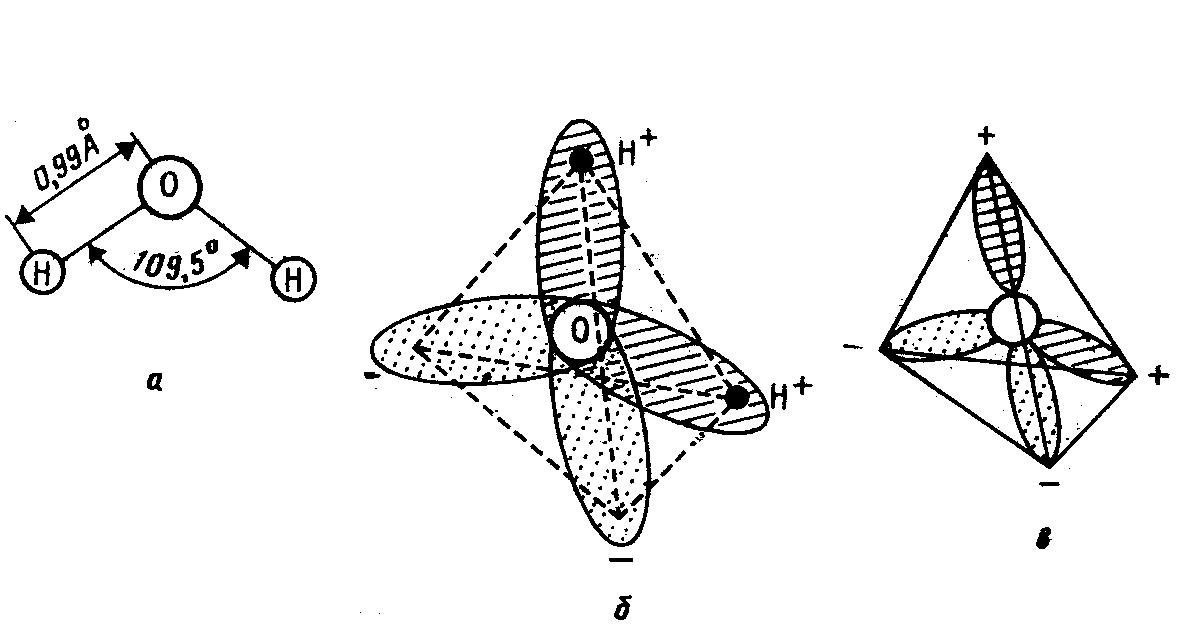
Мал. 2.3. Мономер Н2О: а) геометрична модель молекули Н2О, атоми водню знаходяться по одну сторону від атома кисню; б) електронна модель; два електрони з чотирьох електронів зовнішньої оболонки атома кисню беруть участь у ковалентних зв'язках з атомами водню, а два інших утворюють витягнуті електронні орбіти, площина яких перпендикулярна площини Н-О-Н; в) молекулярна піраміда, спрощена схема тривимірної конфігурації мономера Н2О.
Цікаво, що ця надзвичайно важлива особливість молекули води була встановлена чисто умоглядно задовго до епохи спектроскопічних досліджень англійським професором Д. Берналом [4]. Він виходив з того, що вода має дуже сильний електричний момент (у той час, у 1932 р., це було відоме). Простіше всього, звичайно, молекулу води «сконструювати»,- розташувавши усі вхідні в неї атоми по прямій лінії, тобто Н-О-Н. «Однак, - пише Бернал [4], згадуючи обставини свого відкриття, - водяна молекула подібним чином побудована бути не може, тому що при такій структурі молекула, що містить два позитивних атоми водню і негативний атом кисню, була б електрично нейтрально, не мала б визначену спрямованість. Електричний момент може бути тільки, якщо обидва атоми водню примкнули до кисню з однієї і тієї ж сторони».
Як відомо, атоми в молекули поєднуються за допомогою своїх електронів.
На останній орбіті атома кисню знаходиться 4 електрони. У водню мається усього лише одна електронна орбіта, на якій знаходиться єдиний електрон. Отже, у молекули води всього шість електронів (4 кисневих і 2 від атомів водню), готових до контактів і здатних зробити єдину молекулу з окремих атомів. Щоб з'єднати два атоми водню з одним атомом кисню, досить двох зв'язків. Здавалося б, саджаємо на кожен зв'язок по трьох електронів - і молекула Н2О готова. Але три електрони знаходитися на одному зв'язку, як відомо, не можуть. Тому в утворенні кожного ковалентного зв'язку Н—О бере участь єдиний електрон атома водню і лише один електрон атома кисню. При цьому водневий електрон (що несе негативний заряд) зміщається у бік кисню, в результаті чого та частина молекули Н2О, де розташовується водень, стає позитивно зарядженою.
Отже, долю двох кисневих електронів ми з'ясували. Що ж роблять два інших кисневих електрони? Доти поки ми стежимо за однією ізольованою молекулою Н2О, ці електрони залишаються вільними, ніяк не беручи участь в утворенні молекули Н2О, за що вони одержали назву неподіленої пари. (Але в утворенні молекулярної структури води вони будуть відігравати вирішальну роль) [4].
Молекула
Н2О
немов намагається відіпхнути ці
неподілені електрони подалі від зв'язків
О-Н. Тому орбіти сильно витягнуті убік,
протилежну атомам водню, а для того, щоб
ще більше видалити неподілену пару,
площини орбіт повернені перпендикулярно
площини О—Н—О. Таким чином, конфігурація
молекули води тримірна, форма її схожа
на пакет молока (див. мал. 2.3.в), у центрі
якого знаходиться атом кисню, а в двох
по атому водню. Різні ребра цієї
молекулярної піраміди заряджені
по-різному, тому молекула води має
значний дипольний момент величиною
1,87 Д (1 Д дорівнює 8![]() Кл
∙ м) [4].
Кл
∙ м) [4].
Повернемося тепер до фізичного походження водневого зв'язку, що розглянемо на прикладі О-Н…О. Квантовомеханичний стан цієї системи визначається положенням чотирьох електронів - двох від зв'язку О-Н і двох електронів неподіленої пари другого атома кисню. У такій системі можливо п'ять різних валентних структур (мал. 2.4).
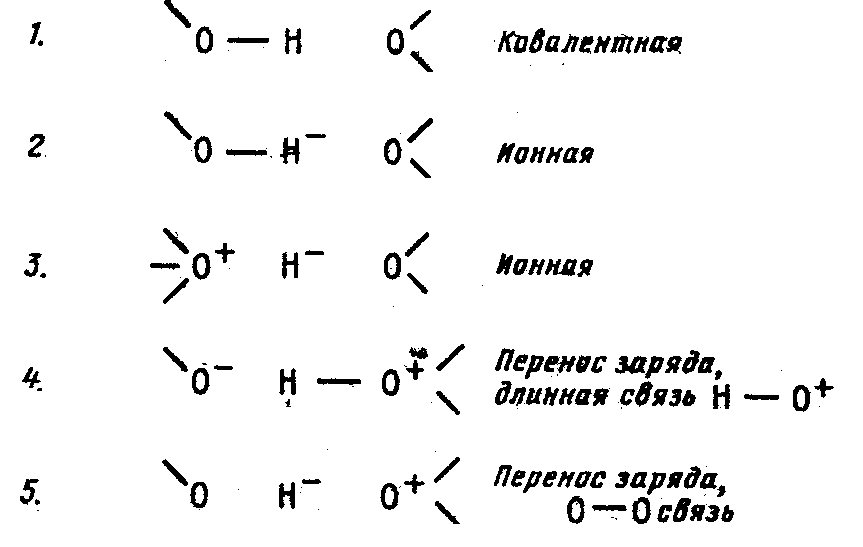
Мал.2.4. Валентні структури, що відповідають водневому зв'язку.
Суто електростатичній взаємодії відповідають тільки 1, 2 і 3 структури, що дають енергію 6 ккал/моль. У сумарну энергию водневого зв'язку входить також енергія делокалізації заряду, що пов'язана зі зниженням енергії стосовно структури 1, викликаною гібридизацією з чотирма іншими структурами (ця енергія дорівнює 8,0 ккал/моль). Цим двом взаємодіям перешкоджає відштовхування, енергія якого 8,4 ккал/моль. Крім того, у загальну енергію вносить свій внесок дисперсійна взаємодія з енергією близько 3 ккал/моль. Отримана в такий спосіб енергія водневого зв'язку (6+8–8,4+3=8,6 ккал/моль) близька до екстремальних значень [4].
Електронна структура молекули Н2О визначає умови об'єднання окремих молекул у складну тривимірну конструкцію.
Цей атом може бути як біля «свого» атома кисню в точці 1, так і біля «чужого» у точці 1'. Кожна з молекул Н2О може утворювати ще по три водневих зв'язку, ліва молекула в напрямках 2Н, А і В, права - у напрямках 3Н, 4Н і С.
Виявилося, що електронна структура молекули води дозволяє їй бути одночасно і донором, і акцептором, що робить цю молекулу ідеальним (і, як ми побачимо нижче, єдиним) матеріалом для побудови розгалуженої мережі водневих зв'язків, і в найбільш досконалому вигляді така мережа існує в льоді. Кожний із протонів водню будь-якої молекули води може міцно зв'язуватися з витягнутим неподіленим електроном іншої молекули (при цьому перша молекула виявляється донором, а друга - акцептором) і утворювати новий водневий зв'язок. Два протони плюс два неподілених електрони - отже, кожна молекула Н2О може брати участь у чотирьох водневих зв'язках, одночасно утворених однією молекулою.
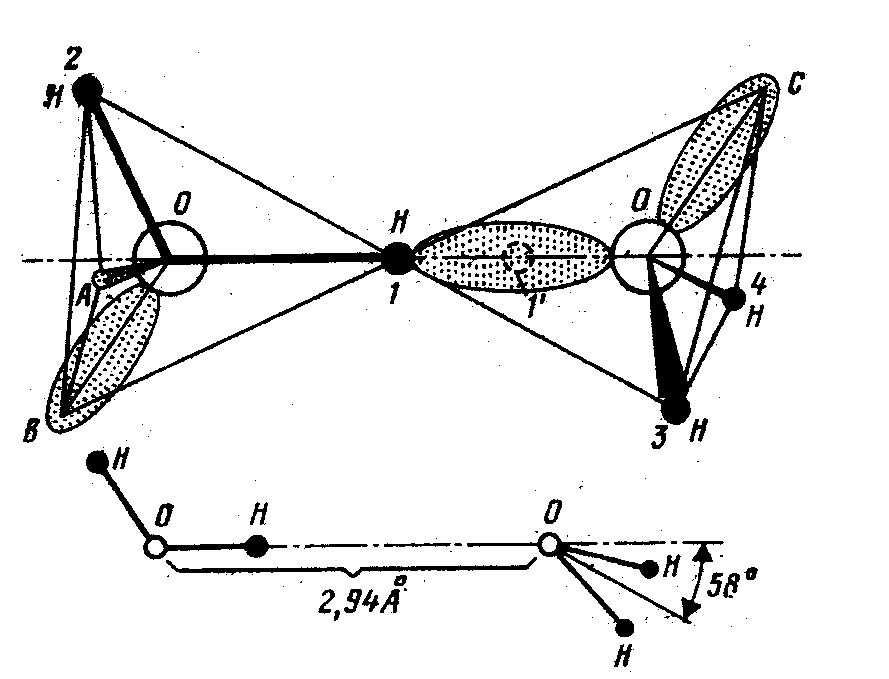
Мал. 2.5. Димер (Н20)2. Дві молекули Н2О з'єднані водневим зв'язком за допомогою атома водню, позначеного цифрою 1.
Кількість водневих зв'язків, утворених однією молекулою, - важлива характеристика будь-якої речовини, але достаток цих зв'язків у молекули Н2О сам по собі ще не може пояснити походження унікальної молекулярної конструкції, що робить воду аномальною рідиною. Вкрай важливо, як ці зв'язки орієнтовані. На мал. 2.5 показано, яким чином дві молекули Н2О поєднуються в комплекс, називаний дімером води (Н2О)2 . У вільному стані такі дімери існують у водяній парі, однак принципові особливості цієї структури зберігаються й у рідкій воді, і в льоді. На схемі вже не показані електронні оболонки, але враховані геометричні особливості електронної структури молекули, завдяки яким площина другої молекули 3 - 4 перпендикулярна площині першої молекули 1-О-2 і нахилена під кутом 58° до лінії О-О, що з'єднує атоми кисню двох молекул. Ця, так звана, лінійна структура води досить добре описує реальний водневий зв'язок молекул Н2О. У даному випадку термін «лінійна» означає, що протон, позначений цифрою
1, знаходиться точно на лінії О-О (насправді цей протон трохи відхиляється від О-О зв'язки, кут 1-О-2 дорівнює 2°). Цей протон має два рівноважних положення - він може знаходитися як поблизу «свого» атома кисню, на відстані приблизно 1 Ангстрем, так і поблизу «чужого» атома на відстані 1,7 Ангстрем від «свого», тобто поряд зі звичайним дімером НО-Н . . . ОН2 стабільною виявляється також іонна пара НО ... Н—ОН2 [4].
Усі ці незвичайні властивості води настільки «вдалі» для всього живого на Землі, що перетворюють воду в єдино можливе середовище існування для будь-яких відомих нам форм життя.


Вода - джерело життя на Землі !

3. Фізичні властивості чистої води
3.1. Залежність густини від температури
Чиста вода уявляє собою прозору рідину без кольору і запаху. При тиску 1 атм вода замерзає при температурі 0° С, а кипить при 100° С.
Однією із найважливіших властивостів води є її густина. Масксимальну густину прісна вода маєть при 4° С. При цій температурі один кілограм води займає мінімальний об’єм . При знижені температури від 4° С до 0° С густина зменшується, тобто вода з температурою 4° С знаходиться знизу, а більш холодна підіймається на поверхню, де замерзаєть, перетворившись у кригу.
Густина звичайної криги – твердої кристалічної фази води – меньша густини води, тому крига плаває на поверхні, захищаючи воду від подальшого охолодження. Він виступає у ролі крижаної „шуби”, як вже зазначалося вище, захищая прісноводні об’єкти від повного промерзання. Таким чином формуються умови для життя мешканців водойм при низьких температурах.

В морській воді розчинено велика кількість солей, і вона веде себе при охолоджені зовсім по-іншому. Температура її замерзання залежить від кількості солі, але в середньому складає – 1,9° С. Максимальна густина такої води – при температурі - 3,5° С. Морська вода перстворюється на кригу, не досягаючи максимальної густини. Тому відбувається вертикальне змішування морської води при її охолодженні від плюсової температури до темератури замерзання. Завдяки такої циркуляції нижні горизонти океону збагачуються киснем, а у верхні шарі із нижніх поступає вода, збагачена поживними речовинами. Необхідно зазначити, що як морський, так і прісний крига легше води і плаває на її поверхні, зберігая глубинні шари води в морях і океанах від безпосереднього контакту з холодними масами повітря і утримуючи тим самим тепло.
3.2. Поверхневий натяг
 Є і
інші властивості води, які дозволяють
назвати її дійсно найдивовижнішим
з’єднанням. Річ йде про поверхневий
натяг рідини. Сили взаємодіїї молекул,
складаючих воду, притягують їх одне до
одного, і розірвати ций зв’язок не так
легко. Більшість людей знає шкільний
дослід в якому обережно покладена в
блюдце з водою голка плаває на поверхні.
Також бачили цікавий фокус, коли в повну
склянку води опускають велику кількість
монет и вода не переливається через
край, піднімається невеликим куполом.
Нарешті відома біблійська легенда про
те, що Христос йшов по воді. Всі ці явища
і легенди пов’язані з великим поверхневим
натягом води. Завдяки поверхневому
натягу, вода підіймається по капілярним
каналам у грунті на поверхню Землі,
поступає в тканини і клітини рослин і
живих істот. Із усіх відомих рідин
тільки у ртуті сила поверхневого натягу
більша ніж у води.
Є і
інші властивості води, які дозволяють
назвати її дійсно найдивовижнішим
з’єднанням. Річ йде про поверхневий
натяг рідини. Сили взаємодіїї молекул,
складаючих воду, притягують їх одне до
одного, і розірвати ций зв’язок не так
легко. Більшість людей знає шкільний
дослід в якому обережно покладена в
блюдце з водою голка плаває на поверхні.
Також бачили цікавий фокус, коли в повну
склянку води опускають велику кількість
монет и вода не переливається через
край, піднімається невеликим куполом.
Нарешті відома біблійська легенда про
те, що Христос йшов по воді. Всі ці явища
і легенди пов’язані з великим поверхневим
натягом води. Завдяки поверхневому
натягу, вода підіймається по капілярним
каналам у грунті на поверхню Землі,
поступає в тканини і клітини рослин і
живих істот. Із усіх відомих рідин
тільки у ртуті сила поверхневого натягу
більша ніж у води.
3.3. Властивість розчиняти речовини
Але найцікавіша властивість води – її здатнисть розчиняти інші речовини. Здатність речовин до розчинення залежить від діелектричної константи: чим вона вища, тим більше спроможна речовина розчиняти інші. Для води ця величина вище, ніж для повітря, чи вакууму у 9 разів. Тому прісна або чиста вода майже не зустрічаються в природі. У звичайній воді завжди щось розчинено. Це можуть бути гази, молекули чи йони хімічних елементів. Припускають, що у водах Світового океану можуть бути розчинені усі елементи таблиці переодичної системи елементів. На даний час їх знайдено більш ніж 80.
З чим пов’язана така властивість води, як розчинність?
Скоріш за все, що всі властивості води визначаються тими хімічними елементами, що входять до її складу. Ці елементи – водень і кисень – широко поширені як у Космосі, так і на Землі.
