
- •Методические рекомендации по самостоятельной работе студентов
- •Содержание
- •Введение
- •1 Методические указания к изучению курса «Химия»
- •2 Структура и содержание дисциплины
- •2.1. Цели освоения дисциплины
- •2.2 Содержание дисциплины
- •Раздел 1. Реакционная способность веществ
- •Раздел 2. Общие закономерности химических процессов
- •Раздел 3. Растворы. Дисперсные системы
- •Раздел 4. Электрохимические процессы
- •Раздел 5. Избранные вопросы химии
- •3/ Вопросы для самоконтроля
- •5 Типовые задачи строение атома и периодическая система элементов д.И. Менделеева Примеры решения задач
- •Контрольные задания
- •Химическая связь Примеры решения задач
- •Контрольные задания
- •Энергетика химических процессов Примеры решения задач
- •Контрольные задания
- •Скорость химической реакции Примеры решения задач
- •Контрольные задания
- •Химическое равновесие Примеры решения задач
- •Контрольные задания
- •Способы выражения концентрации раствора Примеры решения задач.
- •Контрольные задания
- •Свойства растворов неэлектролитов Примеры решения задач
- •Контрольные задания
- •Растворы электролитов Примеры решения задач
- •Контрольные задания
- •Комплексные соединения Примеры решения задач
- •Контрольные задания
- •Гидролиз солей Примеры решения задач
- •Контрольные задания
- •Окислительно-восстановительные реакции Примеры решения задач
- •Контрольные задания
- •Электрохимичкские системы электродные потенциалы и гальванические элементы.
- •Контрольные задания
- •Электролиз Примеры решения задач
- •Решение:
- •Контрольные задания.
- •Коррозия металлов Примеры решения задач
- •Контрольные задания.
- •Общие свойства металлов Примеры решения задач
- •Контрольные задания
- •Приложение
- •Лантаноиды
- •Актиноиды
- •Список рекомендуемой литературы
Контрольные задания
1. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных d- орбиталей у атомов последнего элемента?
2. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента, неверны: а) 1s22s22p53s1; б) 1s22s22p6; в) 1s22s22p63s23p63d4; г) 1s22s22p63s23p64s2; д) 1s22s22p63s23d2? Почему? Атомам каких элементов отвечают правильно составленные электронные формулы?
3. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит «провал» одного 5s – электрона на 4d – подуровень. К какому электронному семейству относится каждый из этих элементов?
4. На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных подгруппах?
5. Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая, что у первого происходит «провал» одного 4s- электрона на 3d-подуровень. Чему равен максимальный спин d-электронов у атомов первого и p-электронов у атома второго элементов?
6. Сколько вакантных 3d- орбиталей имеют возбужденные атомы: а) Cl; б) V; в) Mn?
7.Укажите особенности электронных конфигураций атомов меди и хрома. Сколько 4s- электронов содержат невозбужденные атомы этих элементов?
8.Атом какого элемента в основном состоянии имеет электронную конфигурацию 1s22s22p63s1? Определите общее число энергетических уровней и подуровней, занимаемых электронами в данном атоме.
9.Запишите электронную конфигурацию атома ванадия (V) в основном состоянии и все квантовые числа его неспаренных электронов. Сколько свободных d- орбиталей содержится на предвнешнем энергетическом уровне?
10. Напишите краткую электронную конфигурацию атомов кремния (Si) и свинца (Pb). Являются ли они аналогами электронной структуры?
11. Составьте электронно-графические схемы ионов Fe2+ и Fe3+. Чем можно объяснить особую устойчивость электронной конфигурации иона Fe3+?
12. Напишите электронные формулы ионов: а) Sn2+; б) Sn4+; в) Mn2+; г) Cu2+; д) Cr3+; е) S2-.
13. У какого из p- элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атомов этих элементов.
14. У какого элемента четвертого периода – хрома или селена- сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
15.Какой из элементов четвертого периода - ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов.
Химическая связь Примеры решения задач
Пример 1. Вычислить разность относительных электроотрицательностей атомов для связей Н — О и О — Э в соединениях Э(ОН)2, где Э — Мġ, Са или Śг, и определить: а) какая из связей Н — О или О — Э характеризуется в каждой молекуле большей степенью ионности; б) каков характер диссоциации этих молекул в водном растворе?
Решение. По данным табл. 1 вычисляем разность электроотрицательностей для связей О — Э: Δ хм8 - О = 3,5 - 1,2 ═ 2,3; Δ х са-О =3,5 - 1,04 = 2,46;
Δ ХŚг —О ═ 3,5 .— 0,99 = 2,51. Разность электроотрицательностей для связи О —Н составляет 1,4 .
Таким образом: а) во всех рассмотренных молекулах связь Э – О более полярна, т.е. характеризуется большей степенью ионности: б) диссоциация на ионы в водных растворах будет осуществляться по наиболее ионной связи в соответствии со схемой: Э(ОН)2 ═ Э2++ + 2ОН-;следовательно, все рассматриваемые соединения будут диссоциировать по типу оснований.
Таблица 1 Относительная электроотрицательность атомов
Н 2,1 |
||||||
Li 0,98 |
Bе 1,5 |
В 2,0 |
С 2,5 |
N 3,07 |
О 3,5 |
Р 4,0 |
Nа 0,93 |
Мġ 1,2 |
А1 1,6 |
Si 1,9 |
Р 2,2 |
S 2,6 |
С 3,0 |
К 0,91 |
Са 1,04 |
Gа 1,8 |
Gе 2,0 |
Аs 2,1 |
Sе 2,5 |
Вг 2,8 |
RЬ 0,89 |
Sг 0,99 |
1n 1,5 |
Sn 1,7 |
SЬ 1,8 |
Те 2,1 |
I 2,6 |
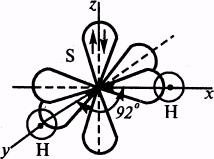
Пример 2. Определите пространственную структуру молекулы Н2S . Почему валентный угол чуть больше 90°?
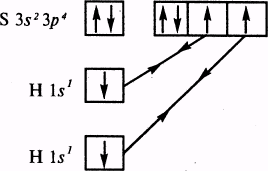
Пример 3. Объяснить механизм образования молекулы SbF4 и иона
SbF62- . Может ли существовать ион СF62- ?
Решение. Электронная конфигурация атома кремния 1s22s22р63s23р2. При возбуждении атом кремния переходит в состояние 1s22s22р63s13р3. Четыре неспаренных электрона возбужденного атома могут участвовать в образовании четырех ковалентных связей по обычному механизму с атомами фтора (1s22s22р5), имеющими по одному неспаренному электрону, с образованием молекулы SbF4.
Для образования иона SbF62- к молекуле SbF4 должны присоединиться два иона F- (1s22s22p6) , все валентные электроны которых спарены. Связь осуществляется по донорно-акцепторному механизму за счет пары электронов каждого из фторид-ионов и двух вакантных 3d-орбиталей атома кремния.
Углерод (1s22s22p2) может образовывать, подобно атому кремния, соединение С F4, но при этом валентные возможности углерода будут исчерпаны ( нет неспаренных электронов, неподеленных пар электронов и вакантных орбиталей на валентном уровне ).Ион С F62- образоваться не может.
Пример 4. Объяснить с позиций метода МО возможность существования молекулярного иона Не2+ и невозможность существования молекулы Не2.
Решение. В молекулярном ионе Не2+ имеются три электрона. Энергетическая схема образования этого иона с учетом принципа Паули представлена ниже:
АО МО АО
Не Не2+ Не+
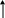 σразр
1s
σразр
1s





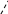 1s 1s
1s 1s
σсв 1s
На связывающей орбитали размещены два электрона, а на разрыхляющей — один. Следовательно, кратность связи в этом ионе равна 0,5, и он должен быть энергетически устойчивым.
Напротив, молекула Не2 должна быть энергетически неустойчива, поскольку из четырех электронов, которые должны разместиться на МО, два займут связывающую МО, а два — разрыхляющую. Следовательно, образование молекулы Не2 не будет сопровождаться выделением энергии. Кратность связи в этом случае равна нулю — молекула не образуется.
Пример 5. Одинаковая ли полярность молекул SНз и ВНз?
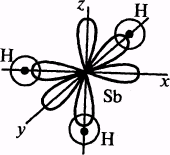
Решение. Для оценки полярности молекулы используют величину электрического момента диполя молекулы μм, равную векторной (геометрической) сумме электрических моментов диполей всех связей μсв (и неподеленных электронных пар). У неполярных молекул эта сумма равна нулю ( μм = 0 ), у полярных — больше нуля (μм>0).
Связи в молекуле SЬНз образуются перекрыванием трех р-орбиталей атома сурьмы (5s25p3) с тремя s-орбиталями трех атомов водорода (1s1). Поскольку 3p-облака ориентированы в трех взаимно перпендикулярных направлениях (по осям х, у, z ), то связи в образовавшейся молекуле SЬНз направлены от вершины тригональной пирамиды, в которой находится атом сурьмы, к ее основанию, в вершинах которого находятся атомы водорода. Следовательно, молекула SЬНз имеет пирамидальную структуру. Сумма векторов моментов диполей всех связей в молекуле SЬНз не равна нулю, и следовательно, молекула в целом полярна.
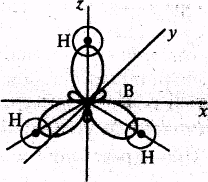
Ковалентные полярные связи в молекуле ВНз образуются перекрыванием трех гибридных орбиталей атома бора (2s12р2) с s-орбиталями трех атомов водорода. Гибридные связи направлены под углом 120°. Ядра всех взаимодействующих атомов лежат в одной плоскости
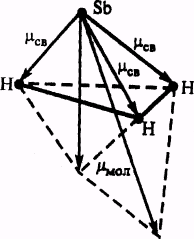
Молекула имеет структуру плоского треугольника. Векторная сумма электрических моментов диполей связей в молекуле равна нулю, следовательно, молекула ВН3 неполярна.
Пример 6. Какая из молекул В2 или С2 характеризуется более высокой энергией диссоциации на атомы? Сопоставьте магнитные свойства этих молекул.
Решение. Молекула В2 образуется в результате взаимодействия двух атомов бора .
В (…2s22p1) + В (…2s22p1) =В2 [(σ2s)2(σ*2s)2(π2ρy)1(π2ρz)1].
На связывающих орбиталях размещены четыре электрона, на разрыхляющих – два, следовательно, порядок связи в молекуле В2 равен (4-2)/2 = 1.
Молекула С2 образуется в результате взаимодействия двух атомов углерода
С(…2s22 ρ2) + С(…2s22 ρ2) = С2 [(σ2s)2(σ*2s)2(π2ρy)2(π2ρz)2].
На связывающих орбиталях размещены шесть электронов, на разрыхляющих – два, следовательно, порядок связи в молекуле С2 равен (6 – 2)/2 = 2 Таким образом, молекула С2, характеризующаяся более высоким порядком связи между атомами, должна быть более прочной.
Этот вывод соответствует экспериментально установленным значениям энергии диссоциации на атомы молекул В2 (276 кДж/моль) и С2 (605 кДж/моль).
В молекуле В2 два электрона расположены, согласно правилу Гунда, на двух π2ρ-орбиталях. Наличие двух неспаренных электронов сообщает этой молекуле парамагнитные свойства. В молекуле С2 все электроны спарены, следовательно, эта молекула диамагнитна.
