
- •А. Различие в размерах атомов
- •Б. Изменение поляризационных свойств ионов
- •В. Различие в электронном строении компонентов
- •Г. Разный механизм образования химических связей
- •Д. Изменение концентрации электронов
- •Е. Изменение активности неподеленной пары электронов у p-катионов
- •Структурная гомология
Е. Изменение активности неподеленной пары электронов у p-катионов
Неподеленная пара электронов (Е-пара) у неполновалентных p-катионов (например, Bi3+, Sn2+, Pb2+, Tl+) может быть активной и пассивной, что определяет стереохимию соединений на основе этих катионов.
В морфотропном ряду PbO (пр. гр. P4/nmm, КЧ Pb=4, КП – телесный угол) → PbS (СТ NaCl, пр. гр. Fm3m, КЧ Pb=6, КП – октаэдр) → PbSe (СТ NaCl) → PbTe (СТ NaCl) стереохимическая активность Е-пары уменьшена с помощью увеличения размеров анионов, окружающих атом Pb2+ (rTe > rSe > rS > rO), и уменьшением их поляризующей способности. Структуру красного PbO можно представить как искаженную структуру CsCl, в которой катионы Pb2+ за счет активности неподеленной пары электронов смещаются из центра объема ячейки к нижнему основанию, что сопровождается понижением координационного числа до четырех и учетверением исходной элементарной ячейки.
Таким образом, в современном понимании морфотропным рядом называется ряд однотипных (по стехиометрии) соединений, в котором постепенное изменение каких-либо свойств (состава, соотношения размера атомов, типа химической связи и т. п.) приводит к скачкообразному, но закономерному изменению структуры.
В рассмотренных рядах структурные изменения обусловлены заменой в соединении одного иона или структурной единицы другим. Анализ с точки зрения морфотропии кристаллических структур соединений, в ряду которых закономерно изменяется структурная единица, впервые применен Ф. Махачки (1928) для выявления кристаллохимических закономерностей в классе силикатов.
Строение силиката общего вида Mx[SiyOz] согласно Махачки зависит от отношения числа атомов кислорода к числу атомов кремния O/Si в формульной единице. Если O/Si > 4, то могут образоваться изолированные SiO4-тетраэдры, а если O/Si < 4, то они должны соединяться между собой общими вершинами (мостиками), образуя большое разнообразие конденсированных (полимерных) форм кремнекислородных радикалов (Рис. 12.4). В таблице 2 приводится ряд важнейших кремнекислородных радикалов от изолированных SiO4-тетраэдров до трехмерного каркаса SiO2 в зависимости от отношения O/Si.
Таблица 2. Основные типы кремнекислородных радикалов как функция атомных отношений O/Si и M/Si
O/Si |
Формула анионного радикала |
Форма радикала |
M/Si |
4:1 |
[SiO4]4- |
изолированный тетраэдр |
2:1 |
7:2 |
[Si2O7]6- |
диортогруппа |
3:2 |
3:1 |
[Si3O9]6-, [Si4O12]8-, [Si6O18]12- |
кольца |
1:1 |
3:1 |
∞ [SiO3]2- |
цепь |
1:1 |
11:4 |
∞ [Si4O11]6- |
лента |
3:4 |
5:2 |
2∞ [Si4O10]4- |
слой |
1:2 |
2:1 |
3∞ [SiO2] |
каркас |
0:1 |
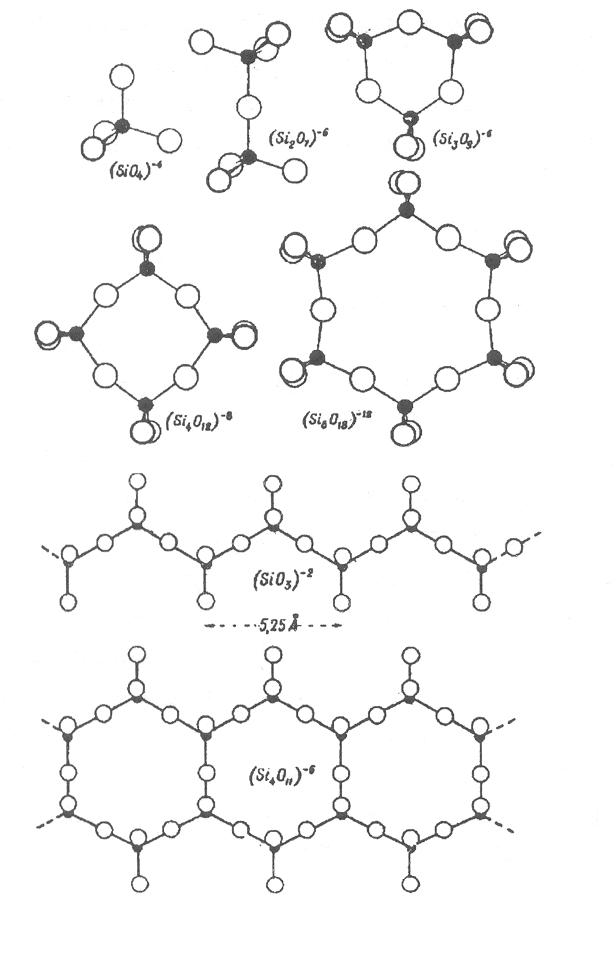
Рис. 12.4. Форма изолированных кремнекислородных группировок, цепочек и лент.
Множество силикатов можно представить как типичный морфотропный ряд, если за основу взять не “классическое” отношение O/Si, а отношение суммы двухвалентных эквивалентов электроположительных катионов (обозначим ее обобщенно M) к числу атомов кремния M/Si. Для этой цели удобно выразить химическую формулу силиката в виде (MxSiy)O2, так что M/Si = x/y. Например, формула форстерита (Mg2SiO4) будет MgSi0.5O2, энстатита (Mg2[Si2O6]) – Mg2/3Si2/3O2 и т.д. Отношение M/Si в таком ряду меняется от 2 для ортосиликатов до 0 для кварца (табл. 2).
В такой записи силикаты (MxSiy)O2 образуют морфотропный ряд, в котором проявляется действительная химическая природа перестройки кристаллической структуры – изменение кислотно-основных свойств катионов, связанных с кислородом. Действительно, средняя электроотрицательность катионов, как нетрудно убедиться, изменяется с M/Si, а именно она тем меньше, чем больше это отношение, так как χ(M) < χ(Si). Вообще атом кремния устойчиво сохраняет тетраэдрическую координацию до тех пор, пока другие катионы в структуре более электроположительны. Оказавшись в роли наименее электроотрицательного катиона, как, например, в SiP2O7, он меняет координацию на октаэдрическую. Иначе говоря, в пирофосфате атом Si играет роль катиона, внешнего по отношению к дитетраэдрическому аниону [P2O7].
Другое преимущество такого подхода заключается в том, что он дает возможность вскрыть характер изменения вдоль морфотропного ряда некоторых важных свойств. При переходе от островных к каркасным структурам несколько увеличивается эффективный заряд атома кремния и увеличивается ионность связи M−O, что приводит к увеличению ковалентности связи Si−O. Это наблюдение соответствует правилу взаимного влияния связей (Урусов, 1975): чем более ионный характер имеет связь M−X в системе M−X−M', тем более ковалентна связь X−M' (O−Si).
Таким образом, анализ особенностей кристаллических структур силикатов – главных породообразующих минералов земной коры – позволяет решать проблемы синтеза веществ – аналогов минералов – с необходимыми физическими свойствами. Возможность анализа с точки зрения морфотропии не является, конечно, спецификой только кристаллохимии силикатов. Подобный подход можно легко применить и для выявления кристаллохимических закономерностей в классах боратов, фосфатов, сульфатов и т.д.
