
- •А. Различие в размерах атомов
- •Б. Изменение поляризационных свойств ионов
- •В. Различие в электронном строении компонентов
- •Г. Разный механизм образования химических связей
- •Д. Изменение концентрации электронов
- •Е. Изменение активности неподеленной пары электронов у p-катионов
- •Структурная гомология
Морфотропией называется резкое изменение кристаллической структуры в закономерном ряду химических соединений при сохранении количественного соотношения структурных единиц. Например, сфалерит ZnS, троилит FeS, ольдгамит CaS принадлежат к трем различным структурным типам: сфалерита, никелина и галита соответственно. Изменение структуры вызвано заменой катиона при том же анионе и соотношении атомных количеств катиона и аниона 1:1.
Рассмотрим на отдельных примерах причины, вызывающие проявление морфотропии.
А. Различие в размерах атомов
В морфотропном ряду химических соединений с общей формулой MIICO3 (табл.1) изменение структуры происходит согласно изменению размера катиона второй группы периодической системы: более крупные катионы (rCa = 1.18 Å , rSr = 1.31Å, rBa = 1.47 Å) образуют карбонаты типа арагонита, а карбонаты содержащие катионы меньших размеров (rMg = 0.72Å, rCa = 1.00Å) принадлежат к структурному типу (СТ) кальцита. Карбонат кальция, имеющий две структурные модификации, попадает в этом ряду на границу морфотропного перехода. Атомы Ca в кальците и арагоните занимают положения, приблизительно соответствующие кубической и гексагональной плотнейшим упаковкам. В обоих случаях группы CO3 окружены шестью атомами кальция. Однако по распределению связей Ca−O эти минералы отличаются один от другого: каждый атом кислорода связан с двумя атомами кальция в кальците и с тремя – в арагоните (рис. 12.1).
Аналогичный морфотропный ряд найден для нитратов: LiNO3 (СТ кальцит) – NaNO3 (СТ кальцит) – KNO3 (СТ арагонит), поскольку радиусы катионов (rLi = 0.76 Å, rNa = 1.02 Å, rK = 1.55 Å) в нитратах также определяют их принадлежность к тому или иному структурному типу.
Б. Изменение поляризационных свойств ионов
Катионы морфотропного ряда CaO (СТ NaCl) − ZnO (СТ ZnS) − SrO (СТ NaCl) − CdO (СТ NaCl) отличаются по величине поляризующей способности – β (β = Ze/r2, где Z – формальный заряд катиона, r – его радиус), причем катионы, имеющие 18-ти электронное строение (Zn, Cd) при близких значениях радиуса и одинаковом формальном заряде поляризуют сильнее: βCa = 1.78 (rCa = 1.00 Å), βZn = 2.90 (rZn = 0.74 Å), βSr = 1.24 (rSr = 1.18 Å), βCd = 1.88 (rCd = 0.95 Å). Кадмий поляризует слабее цинка, так как радиус его больше, чем у цинка, несмотря на их одинаковое электронное строение, поэтому ZnO и CdO кристаллизуются в разных типах структуры.
В. Различие в электронном строении компонентов
Морфотропный ряд MgS (СТ NaCl) − FeS (CТ NiAs) − CoS (СТ NiAs) − MnS (CТ NaCl) − CaS (СТ NaCl) иллюстрирует влияние электронного строения катионов на кристаллическую структуру соединений.
Незаполненные оболочки переходных металлов Fe2+ (3d6) и Co2+ (3d7) оставляют возможности для металл-металл валентных взаимодействий, которые становятся более эффективными при сближении катионов друг с другом. Поэтому FeS и CoS кристаллизуются в структуре типа NiAs, в которой октаэдры вокруг атомов металла имеют общие грани (Рис. 12.2а).
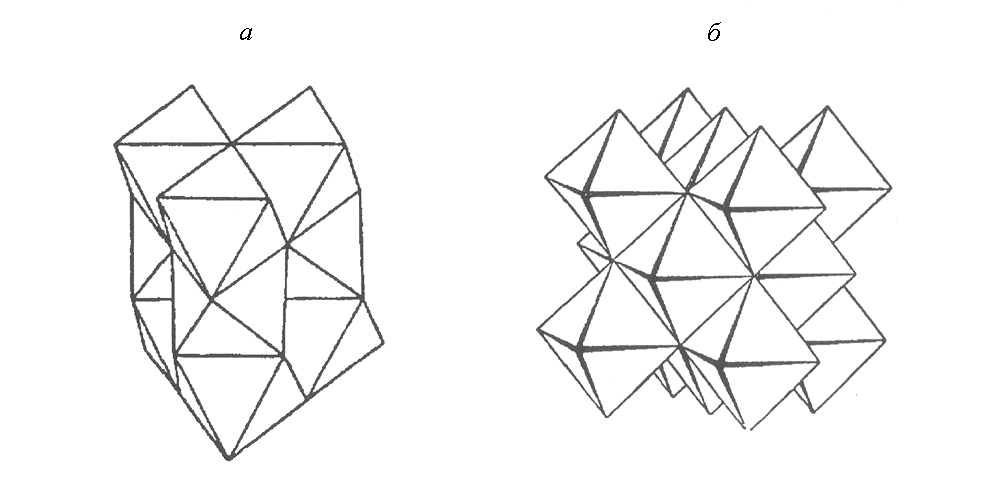
Рис. 12.2. Сочленение октаэдров вокруг атомов металла в СТ NiAs (а) и в СТ NaCl (б).
Отсутствие структуры типа NiAs для устойчивой модификации MnS находит объяснение в том, что Mn2+ обладает наполовину заполненной 3d5 оболочкой, которая по правилу Гунда представляет собой устойчивую конфигурацию (наиболее предпочтительна та конфигурация, в которой электроны занимают разные ячейки и имеют одинаково направленные спины). Такое распределение позволяет электронам находиться дальше друг от друга, чем при других способах их размещения, и поэтому соседние атомы Mn не стремятся обобществлять свои d-электроны за счет образования связей металл-металл. Согласно правилу Гунда, электроны не образуют пары на одной из орбиталей до тех пор, пока на всех других орбиталях той же подоболочки не будет находиться по одному электрону. Это является причиной кристаллизации соединений MgS, MnS и CaS в одном структурном типе NaCl, в котором октаэдры соединяются вершинами и ребрами (Рис. 12.2б).
