
- •Тема 3. Химическая кинетика
- •3.1. Понятие скорости химической реакции. Факторы, влияющие на скорость реакции
- •3.2. Влияние концентраций реагирующих веществ на скорость реакции. Элементарные и сложные реакции. Закон действующих масс
- •3.3 Молекулярность и кинетический порядок реакции
- •3.3.1 Реакции нулевого порядка
- •3.3.2. Реакции первого порядка
- •3.3.3. Реакции второго порядка
- •3.3.4. Методы определения порядка реакции
Тема 3. Химическая кинетика
Кинетикой химических реакций называется учение о скоростях реакций. В кинетике рассматриваются факторы, определяющие скорости реакций, а также промежуточные состояния, при помощи которых достигается конечный результат. Кинетика химических реакций приобрела общее значение, так как её законы оказались применимы для многих других процессов вплоть до ядерных реакций и процессов, протекающих в недрах звезд.
Химическая
кинетика, изучающая реакции в движении,
может быть противопоставлена термодинамике,
которая ограничивается лишь рассмотрением
статики химических реакций – равновесий.
Термодинамика в принципе при наличии
некоторых исходных данных может
предсказывать эти равновесные состояния.
Однако между величиной изменения
свободной энергии при реакции и ее
скоростью не существует прямой связи.
Так, реакция образования воды из H2
и O2
идет с меньшей скоростью, чем реакция
между ионами
![]() и
и
![]() ,
хотя первая сопровождается значительно
большей убылью свободной энергии. Таким
образом, вопросы о том, в течение какого
времени и каким путем совершаются те
или иные процессы, находятся вне рамок
термодинамики и время не входит в
термодинамические уравнения.
,
хотя первая сопровождается значительно
большей убылью свободной энергии. Таким
образом, вопросы о том, в течение какого
времени и каким путем совершаются те
или иные процессы, находятся вне рамок
термодинамики и время не входит в
термодинамические уравнения.
Между тем на практике требуются знания закономерностей, определяющих протекание химических процессов во времени. Это необходимо для разработки методов интенсификации процессов в промышленных агрегатах, а также способов их автоматизации. Так, установление временного закона, описывающего протекание реакции обезуглероживания стали, необходимо для создания автоматического управления конверторами и мартеновскими печами и открывает возможность оптимизации их работы.
Знание кинетических характеристик реакций и процессов необходимо для расчета аппаратуры металлургической промышленности Большое практической значение для интенсификации многих процессов имеет изучение кинетики горения различных видов топлива.
3.1. Понятие скорости химической реакции. Факторы, влияющие на скорость реакции
Реакция называется гомогенной, если все реагирующие вещества находятся в одной фазе, например, реакции между газами, жидкостями. В таком случае реакционным пространством является весь объем системы, в котором протекает реакция.
Реакция называется гетерогенной, если реагирующие вещества находятся в разных фазах. Гетерогенная реакция протекает на поверхности раздела фаз.
Скорость химической реакции равна числу актов взаимодействия в единицу времени в единице объема для реакций, протекающих в гомогенной системе (для гомогенных реакций), или на единице поверхности раздела фаз для реакций, протекающих в гетерогенной системе (для гетерогенных реакций).
Скорость гомогенной реакции количественно можно характеризовать изменением концентрации (обычно молярной) любого участника реакции в единицу времени (как правило, выражаемого в секундах).
Средняя скорость реакции vcp в интервале времени от t1 до t2 определяется соотношением
![]() (3.1)
(3.1)
где c1 и c2 — молярная концентрация любого участника реакции в моменты времени t1 и t2 соответственно. Знак «–» перед дробью относится к концентрации исходных веществ, ∆с < 0, знак « + » – к концентрации продуктов реакции, ∆с > 0.
Мгновенная скорость — это скорость реакции в данный момент времени t. Она определяется производной от концентрации по времени:
![]() (3.2)
(3.2)
и равна тангенсу угла наклона кривой c = f(t) в данной точке (рис. 3.1):
![]()
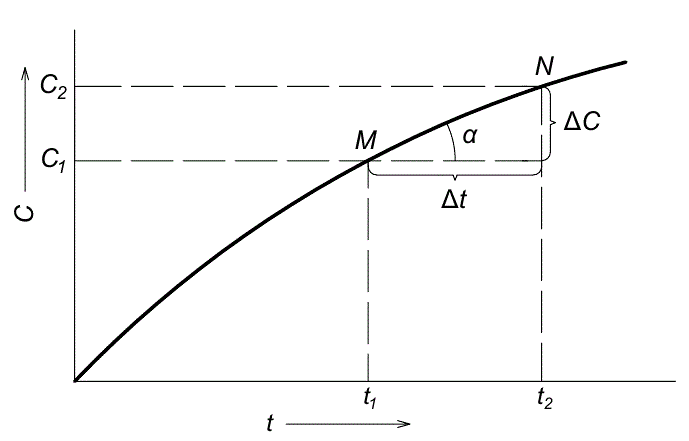
Рис.
3.1. Изменение концентрации
продукта реакции во времени
![]()
Все вещества в уравнении реакции связаны стехиометрическими коэффициентами, поэтому для реакции в общем виде аА + bB = cC + dD получаем
![]()
Основные факторы, влияющие на скорость химической реакции:
– природа реагирующих веществ,
– их концентрация,
– давление (если в реакции участвуют газы),
– температура,
– катализатор,
– площадь поверхности раздела фаз (гетерогенные реакции).
