
229. Яким методом вимірюють поверхневий натяг рідин
A. Кріометрії
B. Метод Тромера
C. *Сталагмометричний метод
D. Комплексонометрії
E. Потенціометричний метод
230. Правило Дюкло-Траубе стверджує, що поверхнева активність ПАР у водних розчинах однакової концентраці:
A. зменшується у 3-3,5 рази із збільшенням довжини ланцюга на одну -СН2 - групу
B. зменшується у 1-1,5 рази із зменшенням довжини ланцюга на одну -СН2 - групу
C. не змінюється із зменшенням довжини ланцюга на одну -СН2 - групу
D. *збільшується у 3-3,5 рази із збільшенням довжини ланцюга на одну -СН2 - групу
E. збільшується у 3-3,5 рази із зменшенням довжини ланцюга на одну -СН2 - групу
231. Зміну концентрації деякого компонента у поверхневому шарі адсорбента називають:
A. Капілярна конденсація
B. Гемосорбція
C. Cорбція.
D. *Адсорбція.
E. Абсорбція.
232. До методів вимірювання поверхневого натягу належить:
A. Кріометрія
B. Метод Тромера
C. *Сталагмометричний метод
D. Комплексонометрія
E. Потенціометричний метод
233. Якщо ∆σ/∆с › 0, то згідно з рівнянням Гібса адсорбція є:
A. Стане безмежною
B. Додатною
C. *Негативною
D. Позитивною
E. Дорівнювати нулю
234. Яке з тверджень правильне:
A. ПАР збільшують поверхневий натяг у 3 рази
B. *ПАР зменшують поверхневий натяг
C. ПАР збільшують поверхневий натяг у 4 рази
D. ПАР не змінюють поверхневий натяг
E. ПАР збільшують поверхневий натяг у 2 рази
235. Поверхневий натяг рідини залежить від:
A. Температури замерзання розчину
B. *Природи речовини
C. Здатності речовини до дифузії
D. Обєму рідини в посудині
E. Зовнішнього тиску на розчин
236. Поверхневий натяг вимірюється в таких одиницях:
A. Н/см2
B. Дж/см
C. *Дж/м2
D. Н/м2
E. Дж/м3
237. Одиниця вимірювання поверхневого натягу - це:
A. Н/м2
B. Дж/м
C. Дж/м
D. *Н/м
E. Дж/м3
238. Яка з речовин є поверхнево-активною (ПАР)?
A. Хлорид калію
B. *Спирт ізопропіловий
C. Хлорид натрію
D. Гідроксид кальцію
E. Кислота хлоридна
239. До поверхнево-інактивних речовин не належить:
A. Хлорид калію
B. *Спирт ізопропіловий
C. Хлорид натрію
D. Гідроксид кальцію
E. Кислота хлоридна
240. Що таке адсорбція?
A. Видалення молекул, які розміщуються в поверхневому шарі
B. Збільшення об’єму речовини
C. Утворення осаду
D. Поглинання речовини всім об’ємом іншої речовини
E. *Зміна концентрації компонентів у поверхневому шарі порівняно з об’ємом фази
241. Енергія, якою володіють молекули, розташовані на межі розділу фаз, називається
A. *Поверхневою енергією
B. Енергією активації
C. Енергією Гемгольца
D. Внутрішнью енергією
E. Ентальпією
242. Якщо адсорбція позитивна, то відношення ∆σ/∆с згідно з рівнянням Гіббса є:
A. *Від’ємне
B. Додатне
C. Дорівнює безмежності
D. Дорівнює 2
E. Дорівнює нулю
243. До поверхнево активних речовин належать всі речовини, крім:
A. Ефір діетиловий
B. Білок
C. Сіль жирної кислоти
D. *Кислота хлоридна
E. Спирт пропіловий
244. Математичний вираз для розрахунку поверхневого натягу такий:
A. σ = C/RT
B. σ = νRT
C. σ = S/G
D. σ = GS
E. *σ = G/S
245. З якого інертного металу виготовляється окисно-відновний електрод?
A. Кальцію
B. Заліза
C. Натрію
D. *Платини
E. Калію
246. У якій сполуці ферум перебуває у відновленій формі
A. Fe2 (S04)3
B. FeCl3
C. *FeSO4
D. Fe (OH)3
E. Fe2O3
247. У якій сполуці ферум перебуває в окисненій формі
A. FeCl2
B. *FeCl3
C. FeSO4
D. Fe(OH)2
E. FeO
248. Яке значення ступеня окиснення мангану у перманганаті калію KMnO4
A. +2
B. *+7
C. +6
D. +5
E. +4
249. Яке значення ступеня окиснення нітрогену у нітриті калію КNО2
A. +1
B. +2
C. *+3
D. +5
E. +7
250. Хлор-срібний електрод виготовляється з металу
A. Кальцію
B. Заліза
C. Натрію
D. *Срібла
E. Калію
251. Потенціометрія - це:
A. Вимірювання густини розчинів
B. Зниження темп. замерзання розчинів
C. Підвищення темп. кипіння розчинів
D. Злиття частинок дисперсної фази при втраті агрегатної стійкості
E. *Фізичний метод дослідження з вимірюванням електрорушійної сили
252. Прилад, в якому відбувається перетворення хімічної енергії в електричну, називається:
A. Термометром
B. Фотометром
C. *Гальванічним елементом
D. Вольтметром
E. Калориметром
253. Роботі хлорсрібного електроду відповідає рівняння:
A. *AgCl + e = Ag + Cl-
B. Ox + Ze = Red
C. Hg2Cl2 + 2e = 2Hg + 2Cl-
D. MA + Ze = M + A z-
E. AgCl = Ag+ + Cl-
254. Схематичний запис цинкового електрода першого роду:
A. Hg/Hg2Cl2, KCl
B. Ag/AgCl, KCl
C. *Zn/Zn2+
D. Zn/ZnSO4, SO42-
E. Pt, H2/2H+
255. Водневому електроду відповідає рівняння:
A. *2H+ + 2e = H2
B. Ox + Ze = Red
C. Hg2Cl2 + 2e = 2Hg + 2Cl-
D. MA + Ze = M + A z-
E. Мz+ +Ze = M
256. Схематичний запис хлорного електрода:
A. *Pt, Cl2/2Cl-
B. Ag/AgCl, KCl
C. Zn/Zn2+
D. Ме/Меn+
E. Pt, H2/2H+
257. Стандартний електродний потенціал, Е0 вимірюється при умовах:
A. Концентрація. іонів металу 1моль/л при 00С
B. Концентрація іонів металу 1моль/л при 200С
C. Концентрація іонів металу 0,1моль/л при 200С
D. Концентрація іонів металу 0,1моль/л при 250С
E. *Концентрація іонів металу 1моль/л при 250С
258. Газовим електродом є електрод
A. Hg/Hg2Cl2, KCl
B. Ag/AgCl, KCl
C. Zn/Zn2+
D. Ag/Ag+
E. *Pt, H2/2H+
259. Схематичний запис водневого електрода
A. Hg/Hg2Cl2, KCl
B. Ag/AgCl, HCl
C. Zn, H2/2H+
D. Fe, H2/2H+
E. *Pt, H2/2H+
260. Потенціал хлорсрібного електрода залежить від концентрації
A. Фосфат-іонів
B. Сульфат-іонів
C. Нітрат-іонів
D. Сульфат-іонів
E. *Хлорид-іонів
261. Схематичний запис каломельного електрода
A. *Hg/Hg2Cl2, KCl
B. Ag/AgCl, KCl
C. Zn/Zn2+
D. Ме/Меn+
E. Pt, H2/2H+
262. Схематичний запис хлорсрібного електрода:
A. Hg/Hg2Cl2, KCl
B. *Ag/AgCl, KCl
C. Zn/Zn2+
D. Ме/Меn+
E. Pt, H2/2H+
263. У склад водневого електрода входить:
A. Срібна пластина, занурена в розчин нітрату срібла
B. Платинова пластина, занурена в розчин власних іонів
C. Платинова пластина, занурена в розчин сульфату цинку
D. Платинова пластина, занурена в розчин хлориду натрію
E. *Платинова пластина, занурена в розчин сірчаної кислоти
264. До електродів 2-го роду належить електрод
A. Водневий
B. Залізний
C. Мідний
D. Срібний
E. *Хлорсрібний
265. Що
означає е0
у
рівнянні Нернста
A. Ізохорно-ізотермічний потенціал
B. Ізобарно-ізотермічний потенціал
C. Хімічний потенціал
D. Електрорушійну силу
E. *Стандартний електродний потенціал
266. Що
означає
у
рівнянні Нернста
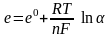
A. Електродний потенціал
B. Число електронів
C. Об”єм розчину
D. *Активність іонів
E. Валентність
267. Що означає n у рівнянні Нернста
A. Число еквівалентів
B. *Число електронів
C. Кількість речовини
D. Ступінь окиснення металу
E. Валентність
268. Електрорушійна сила вимірюється у.таких одиницях...
A. Ватах
B. Метрах
C. *Вольтах
D. Джоулях
E. Амперах
269. При якій температурі вимірюється стандартний електродний потенціал?
A. 278 К.
B. *298 К
C. 293 К
D. 273 К
E. 300 К
270. Одиниця вимірювання електродного потенціалу - це.
A. Ват
B. Метр
C. Джоуль
D. *Вольт
E. Ампер
271. Одиниця вимірювання електродного потенціалу - це.
A. Вт
B. М
C. Дж
D. *В
E. А
272. Система, в якій хімічна енергія окисно-відновного процесу перетворюється в електричну, називається ...
A. Хімічним елементом
B. Поляриметром
C. *Гальванічним елементом
D. Термостатом
E. Кріоскопом
273. Величину електродного потенціалу розраховують за рівнянням:
A. Бойля - Маріотта
B. *Нернста
C. Менделєєва - Клайперона
D. Арреніуса
E. Вант-Гоффа
274. До електродів першого роду належить електрод:
A. Cu / Cu(ОН)2
B. Ag / AgCl
C. Hg, Hg2CI2 / KCI;
D. *Ag / AgNO3
E. Ag, AgCI / KCI
275. У стандартному водневому електроді газоподібний водень знаходиться під тиском:
A. 1,013 кПа
B. 1013 Па
C. *101,3 кПа
D. 101,3 Па
E. 10,13 кПа
276. Величина електродного потенціалу не залежить від:
A. Кількості іонів металу
B. *Об’єму розчину
C. Температури розчину
D. Активності іонів металу
E. Стандартного електродного потенціалу
277. Електрорушійну силу, що виникає між двома електродами, вимірюють за допомогою:
A. Ареометра.
B. Манометра.
C. *Потенціометра
D. Міліамперметра
E. Полярографа
278. При зануренні мідної пластини у розчин CuSO4 переважає процес осадження катіонів металу на пластині. Якого заряду набуває пластинка?
A. - 100 В
B. - 10 В
C. *Позитивного
D. Рівного нулю
E. Негативного
279. Електродний потенціал якого електрода умовно дорівнює нулю?
A. Хлорсрібного.
B. Скляного
C. *Водневого
D. Платинового
E. Цинкового
280. Якщо робота гальванічного елемента є процесом термодинамічно оборотним, то робота хімічної реакції визначається зміною:
A. Потенціальної енергії.
B. Внутрішньої енергії
C. *Ізобарно-ізотермічного потенціалу
D. Ентропії
E. Ентальпії
281. Величина стандартного електродного потенціалу залежить тільки від:
A. Тиску
B. Об’єму розчину
C. *Природи електрода
D. Температури
E. Концентрації іонів
282. Величина електродного потенціалу дорівнює стандартному електродному потенціалу при активності іонів металу, що дорівнює:
A. 100 моль/л.
B. 0,01 моль/л.
C. 10 моль/л;
D. 0,1 моль/л;
E. *1 моль/л;
283. Електрорушійна сила, що виникає між двома електродами, дорівнює:
A. Відношенню двох електродних потенціалів
B. Інтегралу двох електродних потенціалів
C. *Різниці двох електродних потенціалів
D. Логарифму двох електродних потенціалів
E. Добутку двох електродних потенціалів
284. Якщо в системі, що складається з металу та розчину його солі, переважає процес переходу іонів металу в розчин, то метал заряджається:
A. Заряд нейтралізується
B. Заряд не змінюється
C. Заряд дорівнює нулю.
D. Позитивно
E. *Негативно
285. Ферменти проявляють високу активність і діють в організмі за:
A. Низького атмосферного тиску
B. Високого атмосферного тиску
C. *Температури тіла
D. Високих температур
E. Низьких температур
286. Природними каталізаторами є:
A. Жири
B. Вуглеводи
C. Вітаміни
D. *Ферменти
E. Високомалекулярні сполуки
287. На швидкість гомогенних реакцій не впливає:
A. *Площа поверхні поділу фаз
B. Температура
C. Природа розчинника
D. Концентрація регента
E. Природа реагуючих речовин
288. З наведених тверджень правильним є:
A. Каталізатор не впливає на швидкість реакції
B. Каталізатор зменщує швидкість хімічної реакції
C. Каталізатор входить до складу продуктів реакції
D. *Каталізатори беруть участь в реакції, але не входять до продуктів реакції
E. Каталізатори не беруть участі в реакції
289. В яких випадках має місце каталітична реакція:
A. Швидкість розчинення NaCl збільшується при нагріванні
B. Швидкість реакції горіння фосфору підвищується при внесенні його в атмосферу кисню.
C. *Швидкість реакції розкладу H2O2 зростає при внесенні в нього оксиду мангану.
D. Інтенсивність реакції горіння вугілля зростає після його подрібнення.
E. Швидкість реакції взаємодії водню з бромом збільшується при нагріванні.
290. Каталізатор пришвидшує хімічну реакцію завдяки:
A. Зростанню площі реагента
B. Зменшення теплоти реакції
C. Зростанню теплоти реакції
D. Підвищенню енергії активації
E. *Зниженню енергії активації
291. Речовини, які пригнічують дію каталізаторів, називаються:
A. Індикаторами
B. Неметалами.
C. Металами.
D. *Інгібіторами.
E. Каталізаторами.
292. Речовини, які пришвидшують хімічну реакцію, але не витрачаються в реакції, називаються:
A. Індикаторами
B. Неметалами.
C. Металами.
D. Інгібіторами.
E. *Каталізаторами.
293. Із наведених рівнянь реакцій оберіть те, що відповідає гідролізу крохмалю:
A. С6Н12О6 + 6О2→ 6СО2+6Н2О
B. CH3COOC2H5 + H2O CH3COOH + C2H5OH.
C. *(C6H10O5)n + nH2O nC6H12O6;
D. nCO2 + mH2O Cn(H2O)m + nO2;
E. C12H22O11 + H2O 2C6H12O6;
