
Титульный лист для альбома или рефератов (2 вида)
.docxФЕРМЕНТЫ (энзимы) - это высокоспецифичные белки, выполняющие функции биологических катализаторов. фермент снижает энергию активации реакции. Это происходит потому, что в присутствии фермента реакция идет по другому пути (фактически происходит другая реакция), например: 1. В отсутствие фермента: А+В = АВ 2. В присутствии фермента: А+Ф = АФ АФ+В = АВФ АВФ = АВ+Ф, где А, В — субстраты, АВ — продукт реакции, Ф — фермент.
ОСОБЕННОСТИ ФЕРМЕНТОВ КАК БИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ
Всем ферментам присущи свойства обычных катализаторов, но так как все ферменты являются белками, то им присущи следующие специфические свойства: 1. Высокая эффективность действия. Ферменты могут ускорять реакцию в 108 -1012 раз 2. Высокая избирательность ферментов к субстратам (субстратная специфичность) и к типу катализируемой реакции (специфичность действия)3. Высокая чувствительность ферментов к неспецифическим физико-химическим факторам среды - температуре, рН, ионной силе раствора и т.д. 4. Высокая чувствительность к химическим реагентам;
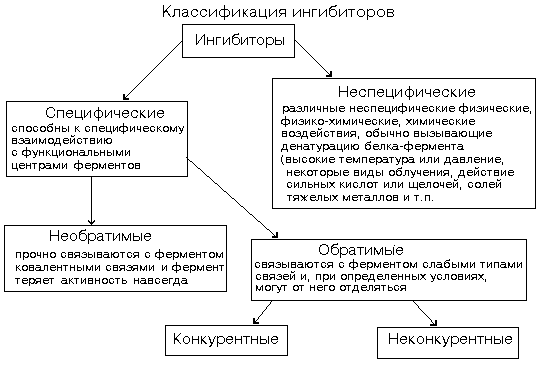
Изменение концентрации субстрата и продукта реакции в ходе самого ферментативного процесса оказывает регулирующее влияние на его скорость. Так, накопление при усиленной мышечной деятельности повышенных количеств аденозиндифосфата и неорганического фосфата замедляет скорость образующей их реакции распада аденозинтрифосфорной кислоты и является причиной ускорения тех процессов (дыхания и гликолиза), которые приводят к их удалению. В итоге регуляция скорости осуществляется по принципу обратной связи - замедление процесса создает условия для его протекания и, следовательно, вызывает его ускорение. Важную регулирующую роль играют имеющиеся в клетке конкурентные отношении за общие субстраты и кофакторы, с одной стороны, и за один и тот же фермент, с другой. Так, глюкозо-6-фосфат может быть субстратом трех важных метаболических процессов: гликолиза, распада углеводов по пентозному циклу и синтеза гликогена. Несколько субстратов могут также конкурировать за один и тот же фермент. Важную роль в этом случае играет относительное сродство фермента к конкурирующему субстрату реакции. Если тот или иной биохимический процесс осуществляется в результате действия целой полиферментной системы, обеспечивающей строгую последовательность ряда реакций, то скорость процесса в целом будет ограничивать самая медленная реакция. Регуляция активности ферментов может осуществляться и путем изо- и аллостерического торможения. В первом случае ингибирующее вещество является стерическим аналогом субстрата, вследствие чего может блокировать активный центр фермента и таким образом препятствовать его взаимодействию с субстратом. Так, малоновая кислота (СООН-СН2-СООН), будучи в структурном отношении очень близка к янтарной кислоте (СООН-СН2-СН2-СООН), является ингибитором фермента сукцинатдегидрогеназы. Во втором случае ингибитор не является структурным аналогом субстрата, он блокирует аллостерические центры белковой молекулы (иные, чем активные центры), что приводит к такому изменению конфигурации молекулы фермента, при котором возникает стерическое несоответствие между ферментом и субстратом, то есть нарушение их комплементарности. Аллостерическимн ингибиторами (эффекторами) часто являются конечные продукты реакции, по мере накопления которых происходит угнетение действия фермента. При удалении аллостерического эффектора или снижении уровня его концентрации фермент вновь переходит в свою активную форму. В этом случае регуляция процесса происходит также по принципу обратной связи. Для регуляции скоростей биохимических процессов большое значение имеет пространственная локализация ферментов и субстратов в клетке.
Оксидоредуктазы. Окислительно-восстановительные реакции. Перенос атомов H и O илиэлектронов от одного субстрата на другой AH + B → A + BH (восстановленный) A + O → AO (окисленный): дегидрогеназа, оксидаза, пероксидаза,редуктаза, монооксидаза, диоксигеназа Трансферазы. Перенос функциональной группы от одного субстрата на другой. Это может быть метильная, ацильная, фосфатная группа или аминогруппа. AB + C → A + BC: аминотрансфераза, фосфотрансфераза, C1-трансфераза, гликозилтрансфераза Гидролазы. Образование двух продуктов из одного субстрата в результате гидролиза .AB + H2O → AOH + BH: эстераза, гликозил-гидролаза, пептидаза,амидаза
Лиазы (синтазы). Негидролитическое добавление или удаление группы к или от субстрата. Образование C-C, C-N, C-O или C-S связи.RCOCOOH → RCOH + CO2: C-O-лиаза, C-S-лиаза, C-N-лиаза, C-C-лиаза Изомеразы. Внутримолекулярная перестановка, то есть изомеризация молекулы субстрата.AB → BA: эпимераза, цис-транс-изомераза,внутримолекулярная оксидоредуктаза и др. Лигазы(синтетазы). Соединение двух молекул в результате синтеза новой C-O, C-S, C-N или C-Cсвязи, сопряжённое с одновременным гидролизом АТФ. X + Y+ ATP → XY + ADP + Pi: C-O-лигаза, C-S-лигаза, C-N-лигаза, C-C-лигаза
© Лузин, Кондрашев, Кочанов.
