
- •Практикум по курсу «Химия окружающей среды»
- •Глава 1. Некоторые вопросы пробоотбора и подготовки проб к анализу
- •§ 1. Отбор проб воды из различных источников.
- •§ 2. Разделение и концентрирование анализируемых компонент природных вод при подготовке проб к анализу.
- •§ 3. Консервирование и хранение проб воды.
- •Глава 2. Методики выполнения лабораторных работ работа 1. «Растворимость кислорода в природных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 2. «Стратификация и баланс содержания кислорода в поверхностных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 3. «Влияние кислорода на редокс-буферность и самоочищение природных вод от редокс-активных загрязнителей ».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 4. «Водородный показатель рН, кислотность природных вод»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 5. «Влияние карбонатов на кислотно-основные равновесия в природных водах»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 6. «Определения класса природных вод по характеристикам минерального состава (минерализация, жесткость природных вод)»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 7. «Определение содержания основных анионов в природных водах. Определение содержания сульфат-ионов различными методами. Определение содержания хлорид-ионов методм Мора».
- •Определение концентрации сульфат-аниона
- •Контрольные вопросы и задания для самостоятельной работы.
- •8. Для чего используется хромат калия в определении хлорид-ионов методом Мора? работа 8. «Определение содержания в воде различных форм азота».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 9. «Качественное определение некоторых загрязнителей в природных и сточных водах»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 10. «Определение искусственных загрязнителей в природных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •«Определение органолептических показателей природных и сточных вод».
- •Хромово-кобальтовая шкала цветности
- •Задание 9. Определение содержания взвешенных частиц.
- •Работа 12. «Определение содержания железа в природных водах. Устойчивость соединений при различных значениях рН воды».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 13. Определение содержание особо токсичных элементов в природных и сточных водах.
- •Контрольные вопросы и задания для самостоятельной работы
- •Общие правила техники безопасности при работе в эколого-аналитической лаборатории.
- •Допустимые значения концентраций загрязняющих веществ в питьевой воде
- •Обобщенные показатели
- •Органолептические показатели
- •Показатели качества воды рыбохозяйственных водных объектов
- •Нормативы предельно допустимых концентраций химических и иных веществ в воде рыбохозяйственных водных объектов (выборочно)
Контрольные вопросы и задания для самостоятельной работы.
Почему природные воды обладают свойством окисляемости? Какие вещества в природных водах обусловливают окисляемость перманганатную, другие виды окисляемости?
В чем заключается сущность явления редокс-буферности природных вод?
Какие процессы в природных водах протекают при участии редокс-буферной системы «кислород-вода»?
Почему природные воды отличаются по величине окислительно-восстановительных потенциалов? Существует ли зависимость между качеством воды и величиной потенциала?
Как измеряют величину окислительно-восстановительного потенциала воды?
Что понимают под самоочищением вод? Какие физико-химические и биохимические процессы в водоемах обеспечивают самоочищение воды от загрязнений?
Работа 4. «Водородный показатель рН, кислотность природных вод»
Цель работы: определить количественные характеристики кислотно-основных равновесий ( , кислотность) в зависимости от условий формирования химического состава природных вод.
Кислотно-основные
свойства природных вод
количественно характеризуют величиной
и
общим содержанием в воде кислот,
реагирующих со щелочами, и оснований,
реагирующих с сильными кислотами.
Водородный показатель
является
наиболее значимым нормируемым показателем
качества воды. Для химически чистой
воды величину водородного показателя
можно рассчитать, используя величину
![]() – ионного произведения воды. Вода –
типичный амфотерный электролит,
электролитическая диссоциация которого
упрощенно отражается уравнениями вида:
– ионного произведения воды. Вода –
типичный амфотерный электролит,
электролитическая диссоциация которого
упрощенно отражается уравнениями вида:
![]()
![]() (1)
(1)
Константа ионизации
воды
![]() 1,810-16
(при 250С)
1,810-16
(при 250С)
![]()
![]() моль/л
моль/л
![]() 1,810-16
1,810-16
Ионное произведение
воды
![]() =
=
![]() =
=
![]() (при 250С)
(при 250С)
=![]() (2)
(2)
![]()
В химически чистой
воде
![]() ,
,
![]() (среда нейтральная). В природных водах
значение водородного показателя может
быть больше или меньше 7 в зависимости
от условий, определяющих формирования
химического состава воды. В естественных
условиях
природных вод определяют следующие
факторы:
(среда нейтральная). В природных водах
значение водородного показателя может
быть больше или меньше 7 в зависимости
от условий, определяющих формирования
химического состава воды. В естественных
условиях
природных вод определяют следующие
факторы:
растворение в воде газов атмосферы с образованием кислот, оснований,
растворение в воде солей, подвергающихся гидролизу,
растворение в воде минеральных и органических компонент почвы,
образование в воде кислотно-основных буферных систем, препятствующих изменению среды
Растворение в воде
газов атмосферы
![]() приводит к подкислению природных вод
(осадков, вод поверхностных водоемов).
Величина
осадков, контактирующих с газами
атмосферы, определяется парциальным
давлением соответствующего газа и
электролитической диссоциацией
образующихся кислот в разбавленных
растворах. Так при парциальном давлении
в атмосферном воздухе 0,035 атм и растворении
его в воде осадков с образованием слабой
угольной кислоты (в естественной
незагрязненной атмосфере) значение рН
осадков определяется концентрацией
ионов
приводит к подкислению природных вод
(осадков, вод поверхностных водоемов).
Величина
осадков, контактирующих с газами
атмосферы, определяется парциальным
давлением соответствующего газа и
электролитической диссоциацией
образующихся кислот в разбавленных
растворах. Так при парциальном давлении
в атмосферном воздухе 0,035 атм и растворении
его в воде осадков с образованием слабой
угольной кислоты (в естественной
незагрязненной атмосфере) значение рН
осадков определяется концентрацией
ионов
![]() ,
образующихся по первой стадии диссоциации
угольной кислоты.
,
образующихся по первой стадии диссоциации
угольной кислоты.
![]()
![]()
![]()
![]()
![]() =
410-7
=
410-7
![]()
![]()
![]() =510-11
=510-11
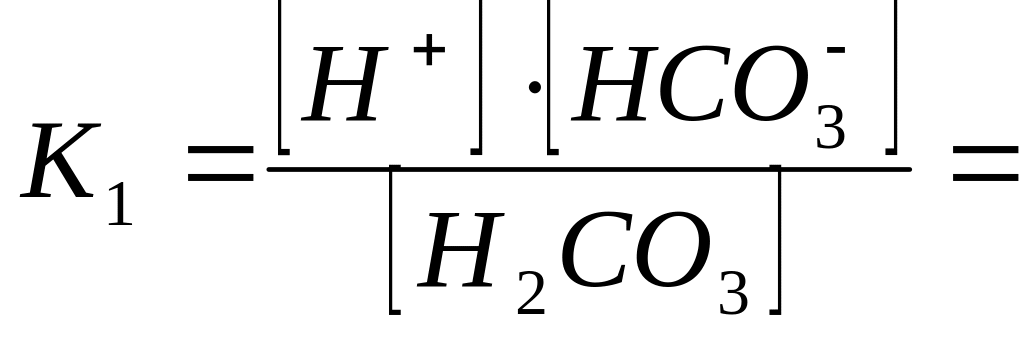
 ,
,
![]() (3)
(3)
Равновесная
концентрация угольной кислоты равна
равновесной концентрации растворенного
углекислого газа, которая, в свою очередь,
определяется величиной
![]() – парциального давления углекислого
газа в воздухе;
– парциального давления углекислого
газа в воздухе;
![]() –
константа Генри для
.
–
константа Генри для
.
![]()
![]() ,
,
![]() (4)
(4)
жидких атмосферных осадков будет равно 5,7. Из естественной незагрязненной атмосферы, содержащей 0,035% , «кислотный» дождь не выпадает. Увеличение концентрации , загрязнение атмосферы сернистым газом, оксидами азота может привести к существенному закислению осадков, выпадению «кислотного дождя» (с ≤4,5). В реальных условиях осадков зависит от степени загрязнения атмосферного воздуха.
Растворение в воде органических компонент почвы: гуминовых, фульвокислот, других органических кислот с константами диссоциации, соизмеримыми с константой диссоциации угольной кислоты, также приводит к формированию слабокислой реакции среды континентальных поверхностных вод. Естественная кислотность природных вод обусловлена содержанием слабых органических кислот природного происхождения. Кислотно-основные свойства почвенно-грунтовых вод будут определяться химической природой минералов, с которыми контактирует соответствующий вид вод. Повышенную кислотность природным водам придают различного вида техногенные загрязнения.
Природные воды в зависимости от рН рационально делить на семь групп:
сильнокислые воды |
рН < 3 |
результат гидролиза солей тяжелых металлов (шахтные и рудничные воды) |
кислые воды |
рН = 3...5 |
поступление в воду угольной кислоты, фульвокислот и других органических кислот в результате разложения органических веществ |
слабокислые воды |
рН = 5...6.5 |
присутствие гумусовых кислот в почве и болотных водах (воды лесной зоны) |
нейтральные воды |
рН = 6.5...7.5 |
наличие в водах Ca(HCO3)2, Mg(HCO3)2 |
слабощелочные воды |
рН = 7.5...8.5 |
то же |
щелочные воды |
рН = 8.5...9.5 |
присутствие Na2CO3 или NaHCO3 |
сильнощелочные воды |
рН > 9.5 |
то же |
ЗАДАНИЕ 1. Определение водородного показателя природных вод потенциометрическим методом.
Метод измерения – основан на потенциометрическом определении , как функции ЭДС гальванического элемента, состоящего из стеклянного индикаторного электрода и электрода сравнения (хлорсеребряного). Потенциал стеклянного электрода определяется концентрацией (активностью) ионов водорода.
Стеклянный электрод относится к мембранным электродам, представляет собой тонкостенный стеклянный шарик, заполненный раствором соляной кислоты (или буферным раствором), внутри шарика помещают вспомогательный хлорсеребряный э электрод. Если два раствора (внутренний раствор в стеклянном шарике электрода и наружный исследуемый раствор) разделены тонкой стеклянной мембраной, то между ее внешней и внутренней поверхностями возникает разность потенциалов, величина которой зависит от активности ионов водорода в исследуемом растворе. Потенциал стеклянного электрода определяется активностью ионов водорода.
![]() (5)
(5)
Измеряемая при помощи иономера (рН-метра) ЭДС равна алгебраической сумме потенциалов стеклянного и хлорсеребряного электродов, зависит от активности ионов водорода в растворе:
![]()
![]() .
(6)
.
(6)
В общем случае при измерениях следует учитывать, что потенциал стеклянного электрода зависит не только от активности ионов водорода, но и от температуры, кислотно-основных свойств среды. В области сильнощелочных или сильнокислых сред возникают так называемые «щелочная ошибка» и «кислотная ошибка» соответственно. Для измерений следует применять стеклянные электроды, предназначенные для работы в определенных интервалах , указанных в их паспорте. В современных -метрах имеется ручная и автоматическая температурная компенсация, позволяющая устранить ошибки, если меняется температура анализируемых проб воды.
Требования безопасности. При измерениях следует выполнять правила работы с электроизмерительными приборами. При обнаружении неисправности прибор немедленно выключить, поставить в известность штатный персонал лаборатории.
Подготовка к выполнению измерений. Подготовить -метр к работе, выполнив мероприятия, указанные в паспорте прибора. Выбрать стеклянный электрод, соответствующий исследуемой воды. Новый стеклянный электрод вымочить в 0,1 н. растворе соляной кислоты в течение не менее 8 ч. Между определениями электрод хранить погруженным (только шарик) в дистиллированную воду. Хлорсеребряный электрод заполнить насыщенным раствором хлористого калия. Внутри электрода должно всегда находиться небольшое количество кристаллов хлористого калия. Провести коррекцию шкалы прибора по буферным растворам (в соответствии с паспортом прибора).
Выполнение измерений. Электроды, термометр ополаскивают дистиллированной, затем исследуемой водой. На штативе укрепляют стеклянный электрод, электрод сравнения и термометр или датчик термокомпенсации прибора. Электрод сравнения устанавливают так, чтобы его нижний конец был ниже шарика стеклянного электрода и предохранял его от механических повреждений. Электроды погружают в стакан с исследуемой водой. Раствор должен полностью покрывать шарик стеклянного электрода. На поверхности стеклянного шарика и в фитиле хлорсеребряного электрода не должно быть пузырьков воздуха. Измеряют . Через 3–5 минут повторяют измерения. Последние два показания прибора должны быть одинаковыми (время установления потенциала электрода около 2–3 мин).
Результаты измерений повторяют для всех проб, результаты вносят в таблицу:
пробы воды |
показания прибора |
пробы |
Характеристика кислотно-основных свойств воды |
|||
через 2 мин |
через 3 мин |
через 5 мин |
через 10 мин |
|||
проба №1 |
|
|
|
|||
проба №2 |
|
|
|
|||
проба №3 |
|
|
|
|||
ЗАДАНИЕ 2. Определение общей кислотности воды титриметрическим методом.
Метод измерения.
Метод основан на измерении объема
![]() мл раствора
(или
)
известной концентрации
мл раствора
(или
)
известной концентрации
![]() ,
затраченного на титрование
,
затраченного на титрование
![]() мл пробы воды в присутствии индикатора
фенолфталеина до точки эквивалентности,
определяемой по изменению окраски
индикатора (кислотно-основное титрование).
мл пробы воды в присутствии индикатора
фенолфталеина до точки эквивалентности,
определяемой по изменению окраски
индикатора (кислотно-основное титрование).
Требования безопасности. При измерениях следует выполнять правила работы со щелочами. В случае пролива раствора, попадания на кожу, в глаза оказать пострадавшему первую доврачебную помощь: промыть пораженное место большим количеством водопроводной воды до исчезновения жжения или ощущения «мылящейся поверхности» на ощупь. Обратиться за специализированной медицинской помощью (возможно быстрее при поражении глаз).
Подготовка к
выполнению измерений. Приготовить
200 мл 0,05 нормального раствора щелочи (
или
).
Стандартные растворы щелочей нельзя
приготовить по точной навеске вещества
или точному объему более концентрированного
раствора. Потому сначала готовят растворы
приблизительной концентрации, а затем
их стандартизируют – устанавливают
точную концентрацию путем титрования
раствором щавелевой кислоты
![]() ,
0,01 н. в присутствии индикатора
фенолфталеина.
,
0,01 н. в присутствии индикатора
фенолфталеина.
![]() + 2
=
+ 2
=
![]() + 2
(7)
+ 2
(7)
Растворы титрантов точной концентрации могут быть приготовлены из фиксаналов.
Выполнение измерений. Заполнить бюретку раствором щелочи, отметить уровень раствора. Отмерить мерным цилиндром 100 мл анализируемой воды, внести в чистую коническую плоскодонную колбу для титрования (емкостью 250 мл), добавить 2–3 капли индикатора. Титровать раствором щелочи, периодически вращая колбу с пробой для перемешивания растворов. Титрование считать законченным, когда окраска раствора не исчезает после перемешивания добавленной капли раствора из бюретки. Окраску пробы рассматривать на белом фоне. Провести ориентировочное и точное титрование. Отметить объем раствора щелочи, затраченный на точное титрование. Рассчитать общую концентрацию кислот в исследуемой воде, моль/л.
Измерения повторить для всех проб, результаты внести в таблицу:
пробы воды |
Объем тируемой пробы, мл |
Объем раствора щелочи, затрченного на тирование, мл |
Общая концентрация кислот в пробе, моль/л |
проба №1 |
|
|
|
проба №2 |
|
|
|
проба №3 |
|
|
|
Сравнить результаты определения общей кислотности и значения для исследуемых проб воды.
