
- •Практикум по курсу «Химия окружающей среды»
- •Глава 1. Некоторые вопросы пробоотбора и подготовки проб к анализу
- •§ 1. Отбор проб воды из различных источников.
- •§ 2. Разделение и концентрирование анализируемых компонент природных вод при подготовке проб к анализу.
- •§ 3. Консервирование и хранение проб воды.
- •Глава 2. Методики выполнения лабораторных работ работа 1. «Растворимость кислорода в природных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 2. «Стратификация и баланс содержания кислорода в поверхностных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 3. «Влияние кислорода на редокс-буферность и самоочищение природных вод от редокс-активных загрязнителей ».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 4. «Водородный показатель рН, кислотность природных вод»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 5. «Влияние карбонатов на кислотно-основные равновесия в природных водах»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 6. «Определения класса природных вод по характеристикам минерального состава (минерализация, жесткость природных вод)»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 7. «Определение содержания основных анионов в природных водах. Определение содержания сульфат-ионов различными методами. Определение содержания хлорид-ионов методм Мора».
- •Определение концентрации сульфат-аниона
- •Контрольные вопросы и задания для самостоятельной работы.
- •8. Для чего используется хромат калия в определении хлорид-ионов методом Мора? работа 8. «Определение содержания в воде различных форм азота».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 9. «Качественное определение некоторых загрязнителей в природных и сточных водах»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 10. «Определение искусственных загрязнителей в природных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •«Определение органолептических показателей природных и сточных вод».
- •Хромово-кобальтовая шкала цветности
- •Задание 9. Определение содержания взвешенных частиц.
- •Работа 12. «Определение содержания железа в природных водах. Устойчивость соединений при различных значениях рН воды».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 13. Определение содержание особо токсичных элементов в природных и сточных водах.
- •Контрольные вопросы и задания для самостоятельной работы
- •Общие правила техники безопасности при работе в эколого-аналитической лаборатории.
- •Допустимые значения концентраций загрязняющих веществ в питьевой воде
- •Обобщенные показатели
- •Органолептические показатели
- •Показатели качества воды рыбохозяйственных водных объектов
- •Нормативы предельно допустимых концентраций химических и иных веществ в воде рыбохозяйственных водных объектов (выборочно)
Глава 2. Методики выполнения лабораторных работ работа 1. «Растворимость кислорода в природных водах».
Цель работы: определение содержания растворенного кислорода в воде поверхностных водоемов (титриметрическим методом).
Кислород постоянно присутствует в растворенном виде в поверхностных водах. Содержание этого газа в растворенном виде в воде имеет важнейшее значение для оценки экологического состояния водоема, так как кислород необходим для дыхания гидробионтов, протекания процессов самоочищения водоемов. Кислород поступает в поверхностные воды в результате абсорбции его водой из атмосферы. Другими источниками поступления кислорода в воды являются процессы фотосинтеза, протекающие при участии водной растительности, дождевые и талые воды, которые обычно пресыщены кислородом.
Растворение кислорода в воде подчиняется общим закономерностям, отражающим процессы растворения газов. При растворении газов в природных водах раствор – это сама природная вода. Растворимость газов – это количество газа, растворенного в единице объема раствора, находящегося в равновесии с газовой фазой. Растворимость газов в воде различна, зависит от химической природы газа, парциального давления газа, температуры, состава природных вод (солености).
При нормальных условиях чистый кислород представляет собой бесцветный газ, не имеющий запаха, состоит из двухатомных молекул, имеет несколько бoльшую плотность, чем воздух, и плохо растворим в воде. Поскольку поверхностные природные воды находятся в состоянии равновесия с газами атмосферы, то абсорбция кислорода из атмосферы протекает при его парциальном давлении 0,21 атм одновременно с другими газами атмосферы. Закон Генри определяет зависимость концентрации растворенного газа в воде от его парциального давления в газовой фазе.
![]() ,
(1)
,
(1)
где
![]() концентрация газа в водном растворе
(природной воде),
концентрация газа в водном растворе
(природной воде),
![]() - парциальное давление газа в газовой
смеси над водой при данной температуре
,
- парциальное давление газа в газовой
смеси над водой при данной температуре
,
![]() - постоянная Генри при этой же температуре.
- постоянная Генри при этой же температуре.
При небольших
давлениях газы атмосферы растворяются
в жидкости независимо друг от друга,
каждый в соответствии со своим парциальным
давлением и коэффициентом растворимости.
При этом соотношение концентраций газов
в растворе отличается от состава газовой
смеси над раствором. Так, соотношение
объемных долей кислорода и азота в
воздухе будет отличаться от соотношения
их концентраций в воде. В воздухе
содержится 79 % азота и 21% кислорода по
объему. Соотношение объемных долей
газов в воде (в %) составляет: 64,4% азота
и 35,6% кислорода. Растворимость азота в
воде при нормальных условиях равна
23,54 мл/л, а растворимость кислорода при
тех же условиях равна 48,89 мл/л. Хотя
растворимость кислорода почти в два
раза превышает растворимость азота,
все же в воде азота растворяется почти
в два раза больше, чем кислорода ввиду
большего значения парциального давления
этого газа в атмосфере. Растворимость
большинства газов в воде по порядку
величины не отличается от растворимости
воздуха, равной 19,0 мл/л при 200С.
Исключение составляют газы, которые
химически взаимодействуют с водой
(аммиак, сернистый газ, углекислый газ,
сероводород и др). Растворимость в воде
![]() равна 1713 мл/л при 00С, растворимость
в воде
равна 1713 мл/л при 00С, растворимость
в воде
![]() равна 4670 мл/л при 00С.
равна 4670 мл/л при 00С.
В соленой морской воде растворимость кислорода уменьшается. Растворимость кислорода в морской воде зависит от температуры и солености. Составлены специальные океанологические таблицы, в которых приведена его растворимость при разных температурах и значениях солености при нормальном атмосферном давлении.
Для кислорода в природных водах приняты две формы выражения его концентрации: 1) мг/л (или мл/л для морской воды), 2) относительное его содержание в % от равновесной концентрации при данной температуре, давлении, минерализации воды, которая принимается равной 100%. Иногда приводят % отклонения от нормального состояния. Например, 80% насыщения указывают как -20%, а 110% как +10%. Кроме того, для озер рекомендованы «абсолютно нормальные проценты», «абсолютно нормальные уклонения», рассчитанные по отношению к растворимости кислорода при 40С. Эта температура принята для расчетов в связи с тем, что при ней происходит весенняя и осенняя циркуляция воды в водоеме, при которой содержание кислорода в воде приходит в равновесие с его содержанием в атмосфере. В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/л.
Содержание растворенного кислорода определяют как в незагрязненных природных водах, так и в сточных водах в процессе очистки, очищенных вод перед сбросом их в водоемы или повторного использования. Определение растворенного кислорода является частью анализа при определении другого важнейшего показателя качества воды – биохимического потребления кислорода (БПК).
ЗАДАНИЕ 1. Определение концентрации растворенного кислорода в чистых природных водах, контактирующих с атмосферой.
Метод измерения – йодометрия (окислительно-восстановительное титрование). Метод основан на взаимодействии в щелочной среде гидроксида марганца с растворенным в воде кислородом. Гидроксид марганца, количественно связывая растворенный в воде кислород, переходит в нерастворимое соединение четырехвалентного марганца коричневого цвета:
![]() (белый)
(2)
(белый)
(2)
![]() (коричневый)
(3)
(коричневый)
(3)

![]()
![]() .
.
При подкислении раствора в присутствии избытка йодистого калия образуется йод, количество которого эквивалентно содержанию растворенного кислорода и учитывается титрованием раствором тиосульфата натрия:
![]() (светло желтый
раствор) (4)
(светло желтый
раствор) (4)

![]()
![]() .
.
![]() (5)
(5)
![]()
![]() .
.
Рабочими растворами
в методе йодометрии являются
стандартизированные растворы
![]() и тиосульфата натрия
и тиосульфата натрия
![]() (восстановитель
метода).
(восстановитель
метода).
Основной
титриметрической реакцией в методе
является взаимодействие раствора йода
и рабочего раствора тиосульфата натрия:
![]()
![]() (6)
(6)
Точка эквивалентности (момент завершения реакции между титрантом и определяемым веществом) фиксируется при помощи индикатора (крахмала), который образует с молекулярным йодом соединение синего цвета. При титровании йода рабочим раствором тиосульфата конец реакции определяется по исчезновению синей окраски от одной капли раствора тиосульфата натрия. Крахмал необходимо добавлять в самом конце титрования, когда йода в растворе мало и раствор приобретает соломенно-желтый цвет. Крахмал, добавленный к раствору с высокой концентрацией йода, становится черным и разрушается, что делает невозможным определение точки эквивалентности. Титрование надо проводить на холоду, так как йод – летучее соединение и при нагревании уменьшается чувствительность крахмала к йоду. Кроме того, рН раствора не должен превышать 9, так как в щелочной среде протекают побочные реакции, что уменьшает точность определения йода.
Точность прямого метода Винклера. Потенциальные источники ошибок метода Винклера в чистых водах следующие: окисление иодида кислородом воздуха, улетучивание молекулярного иода, содержание растворенного кислорода в добавляемых реактивах в процедуре фиксации кислорода, примесь молекулярного йода в иодиде, несовпадение точки конца титрования и точки эквивалентности, малая устойчивость растворов тиосульфата натрия и соответственно необходимость частой стандартизации, ошибки при стандартизации тиосульфата натрия, трудность титрования малых количеств йода, использование крахмала в качестве индикатора (его нестойкость и уменьшение чувствительности с повышением температуры). Погрешность метода Винклера в чистых водах составляет:
30% при 0.05 мг О2/л,
10-20% при 0.2-0.3 мг О2/л,
3-5% при 0.8-1.7 мг О2/л.
В загрязненных поверхностных водах могут присутствовать компоненты, оказывающие мешающее влияние и искажающие результаты определения растворенного кислорода методом Винклера. К таким компонентам относятся следующие группы веществ.
Взвешенные и окрашенные вещества. Они могут помешать определению, адсорбируя йод на своей поверхности или химически взаимодействуя с ним. При наличии в анализируемой воде взвешенных веществ их отделяют отстаиванием (не фильтрованием!) либо осветлением при добавлении раствора алюмокалиевых квасцов и аммиака.
Восстановители,
реагирующие с выделенным йодом в кислой
среде (сульфиты, тиосульфаты, сульфиды).
Для устранения влияния восстановителей
используют метод Росса, основанный на
добавках к пробам растворов гипохлорита
натрия
![]() ,
хлорной извести
,
хлорной извести
![]() и роданида калия
и роданида калия
![]() .
.
Окислители, выделяющие йод из йодида калия (активный хлор, нитриты, катионы железа (III) и др.). Влияние железа (III) устраняется добавлением раствора фторида калия. Влияние нитритов, которые часто встречаются в природных и сточных водах, устраняют добавлением раствора сульфаниловой кислоты.
Требования безопасности. При измерениях следует выполнять правила работы со стеклом, электронагревательными приборами, растворами кислот и оснований, сильных окислителей.
Подготовка к выполнению измерений.
Приготовление раствора хлорида марганца. 210 г
 растворяют в 200 мл дистиллированной
воды. Раствор фильтруют и доводят объем
раствора до 500 мл дистиллированной
водой. Вместо хлорида марганца можно
использовать 240 г
растворяют в 200 мл дистиллированной
воды. Раствор фильтруют и доводят объем
раствора до 500 мл дистиллированной
водой. Вместо хлорида марганца можно
использовать 240 г
 или 200 г
или 200 г
 .
.Приготовление щелочного раствора йодида калия. 15 г
 (или
13,6 г
(или
13,6 г
 )
растворяют в 20 мл дистиллированной
воды; 50 г
)
растворяют в 20 мл дистиллированной
воды; 50 г
 ( или 70 г
( или 70 г
 )
растворяют в 50 мл дистиллированной
воды. Полученные растворы смешивают и
общий объем доводят в мерной колбе до
100 мл.
)
растворяют в 50 мл дистиллированной
воды. Полученные растворы смешивают и
общий объем доводят в мерной колбе до
100 мл.
Приготовление раствора соляной кислоты (2:1). 340 мл концентрированной соляной кислоты добавляют к 170 мл дистиллированной воды. Или 100 мл концентрированной серной кислоты добавляют небольшими порциями к 400 мл дистиллированной воды.
Приготовление раствора крахмала 0,5%. 0,5 г растворимого крахмала (рисовый, пшеничный, маисовый) растворяют в 100 мл холодной дистиллированной воды и нагревают до кипения. Раствор крахмала готовят ежедневно перед работой.
Приготовление раствора бихромата калия 0,02 н. 0,9808 г точно взвешенного перекристаллизованного
 растворяют дистиллированной водой в
мерной колбе объемом 1 л.
растворяют дистиллированной водой в
мерной колбе объемом 1 л.Приготовление раствора тиосульфата натрия
 0,02 н. 5 г
растворяют в 1 л дистиллированной воды.
Добавляют 10 мл амилового или изобутилового
спирта. Раствор используют через 10 дней
после приготовления. Хранят в склянке
из темного стекла.
0,02 н. 5 г
растворяют в 1 л дистиллированной воды.
Добавляют 10 мл амилового или изобутилового
спирта. Раствор используют через 10 дней
после приготовления. Хранят в склянке
из темного стекла.
Стандартизация раствора тиосульфата натрия . В коническую колбу емкостью 250 мл наливают 35 мл дистиллированной воды, всыпают 1 г сухого , добавляют 15 мл 0,02 н раствора (отмерить пипеткой) и 10 мл раствора
 (2:1).
Титрование раствором тиосульфата
начинают сразу после растворения
,
непрерывно помешивая, до появления
слабо желтой окраски. Затем добавляют
50-100 мл дистиллированной воды и 1 мл
раствора крахмала и продолжают титрование
до исчезновения окраски. Вычисляют
нормальность раствора тиосульфата
(2:1).
Титрование раствором тиосульфата
начинают сразу после растворения
,
непрерывно помешивая, до появления
слабо желтой окраски. Затем добавляют
50-100 мл дистиллированной воды и 1 мл
раствора крахмала и продолжают титрование
до исчезновения окраски. Вычисляют
нормальность раствора тиосульфата
 до пятого знака после запятой по
формуле:
до пятого знака после запятой по
формуле: .
.
 - нормальность раствора
;
- нормальность раствора
;
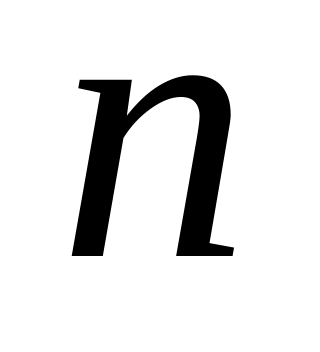 -
объем затраченного на титрование
раствора
-
объем затраченного на титрование
раствора
 (мл);
(мл);
 -
объем раствора
,
взятого для стандартизации раствора
тиосульфата.
-
объем раствора
,
взятого для стандартизации раствора
тиосульфата.
Выполнение измерений.
Отбор пробы, фиксирование кислорода. Отбор пробы воды из водоема для измерения концентрации растворенного кислорода выполняют, используя батометр. Одновременно с отбором пробы следует измерить и зафиксировать значение температуры воды и атмосферного давления. Фиксирование кислорода проводят в специальных стандартных склянках известного объема – кислородных склянках. Предварительно склянку 2-3 раза ополаскивают исследуемой водой. Наполнение их из батометра осуществляют сифоном через резиновую трубку, опущенную до дна склянки. Резиновая трубка батометра должна касаться дна склянки. После наполнения склянки до горлышка ее наполнение продолжить до тех пор, пока не выльется приблизительно 100 мл воды. Трубку вынуть, не прекращая тока воды из батометра. Склянка должна быть заполнена до краев и не иметь внутри на стенках пузырьков воздуха
После заполнения
водой в кислородную склянку с пробой
ввести 1мл раствора
![]() и 1 мл щелочного раствора
(разными пипетками). Пипетку погружать
каждый раз до половины склянки и по мере
выливания раствора поднимать вверх.
Затем быстро закрыть склянку стеклянной
пробкой таким образом, чтобы не осталось
пузырьков воздуха, содержимое склянки
перемешать. Образующемуся осадку дать
отстояться не менее 10 мин и не более
суток.
и 1 мл щелочного раствора
(разными пипетками). Пипетку погружать
каждый раз до половины склянки и по мере
выливания раствора поднимать вверх.
Затем быстро закрыть склянку стеклянной
пробкой таким образом, чтобы не осталось
пузырьков воздуха, содержимое склянки
перемешать. Образующемуся осадку дать
отстояться не менее 10 мин и не более
суток.
Титрование. В склянку с осадком прилить 5 мл приготовленного раствора соляной (или серной) кислоты. Для этого пипетку погрузить до осадка и медленно поднимать вверх. Вытесненная пипеткой жидкость для анализа значения не имеет. Склянку закрыть пробкой, содержимое тщательно перемешать. Отобрать пипеткой 50 мл раствора из склянки (пипетку предварительно ополоснуть этим раствором) и перенести в коническую колбу объемом 250 мл. Раствор титровать 0,02 н раствором тиосульфата пока он не станет светло желтым. Затем прибавить 1 мл свежеприготовленного раствора крахмала и продолжать титрование до исчезновения синей окраски.
Содержание
растворенного кислорода
![]() в мг/л рассчитать по формуле:
в мг/л рассчитать по формуле:
![]() (7)
(7)
![]() - нормальность
раствора тиосульфата (установленная
точная концентрация тиосульфата);
- объем раствора тиосульфата, затраченного
на титрование,мл;
- нормальность
раствора тиосульфата (установленная
точная концентрация тиосульфата);
- объем раствора тиосульфата, затраченного
на титрование,мл;
![]() -
объем склянки, в которую отбиралась
проба воды, мл; 2 - объем пробы воды,
вылившийся при фиксации кислорода.
Результаты внести в таблицу:
-
объем склянки, в которую отбиралась
проба воды, мл; 2 - объем пробы воды,
вылившийся при фиксации кислорода.
Результаты внести в таблицу:
№ п/п |
, моль/л |
, мл |
, мл |
температура воды,
|
атмосферное давление, мм рт.ст. |
концентрация растворенного кислорода в воде, мг/л |
мг/л |
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
ЗАДАНИЕ 2. Определение концентрации растворенного кислорода в водах сапробных природных водаемов (р.Городничанка).
Водоемы, загрязненные органическими веществами, называют сапробными (от греческого слова «сапрос» -гнилой). По степени загрязненности вод органическими веществами водоемы классифицируют на полисапробные, Мезосапробные (подразделяемые на альфа-мезосапробные и бета-мезосапробные) и олигосапробные. Полисапробные – наиболее загрязнены органическими веществами, кислорода для биохимического окисления загрязнителей не хватает. Олигосапробные водоемы содержат незначительное количество органического вещества-загрязнителя, потому содержание кислорода в них определяется балансом его поступления из атмосферы и расходования гидробионтами. Мезосапробные водоемы занимают промежуточное положение по содержанию кислорода между олиго- и полисапробными водоемами. Концентрация кислорода в водах определяет характер продуктов окисления , загрязняющих водоем. В полисапробной зоне водоема органических веществ много, кислорода не хватает для их окисления. Здесь имеет место биохимическое расщепление белков и углеводов. В мезосапробной зоне происходит минерализация органических веществ, образуется сероводород, оксид углерода (IY). Различают альфа- и бета-мезосапробную зоны. Вода в альфа-мезосапробной зоне умеренно загрязнена органическими веществами, здесь есть аммиак и соединения аммония, но кислорода мало. В бета-мезосапробной зоне органических загрязнителей мало; кроме аммиака, есть продукты его окисления (азотная и азотистая кислоты), много кислорода.
Выполнение измерений провести в соответствии с методикой, приведенной в ЗАДАНИИ 1. Сравнить содержание кислорода в чистых и загрязненных органическими веществами природных водах. Сделать вывод о состоянии вод р.Городничанка.
