- •Практикум по курсу «Химия окружающей среды»
- •Глава 1. Некоторые вопросы пробоотбора и подготовки проб к анализу
- •§ 1. Отбор проб воды из различных источников.
- •§ 2. Разделение и концентрирование анализируемых компонент природных вод при подготовке проб к анализу.
- •§ 3. Консервирование и хранение проб воды.
- •Глава 2. Методики выполнения лабораторных работ работа 1. «Растворимость кислорода в природных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 2. «Стратификация и баланс содержания кислорода в поверхностных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 3. «Влияние кислорода на редокс-буферность и самоочищение природных вод от редокс-активных загрязнителей ».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 4. «Водородный показатель рН, кислотность природных вод»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 5. «Влияние карбонатов на кислотно-основные равновесия в природных водах»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 6. «Определения класса природных вод по характеристикам минерального состава (минерализация, жесткость природных вод)»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 7. «Определение содержания основных анионов в природных водах. Определение содержания сульфат-ионов различными методами. Определение содержания хлорид-ионов методм Мора».
- •Определение концентрации сульфат-аниона
- •Контрольные вопросы и задания для самостоятельной работы.
- •8. Для чего используется хромат калия в определении хлорид-ионов методом Мора? работа 8. «Определение содержания в воде различных форм азота».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 9. «Качественное определение некоторых загрязнителей в природных и сточных водах»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 10. «Определение искусственных загрязнителей в природных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •«Определение органолептических показателей природных и сточных вод».
- •Хромово-кобальтовая шкала цветности
- •Задание 9. Определение содержания взвешенных частиц.
- •Работа 12. «Определение содержания железа в природных водах. Устойчивость соединений при различных значениях рН воды».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 13. Определение содержание особо токсичных элементов в природных и сточных водах.
- •Контрольные вопросы и задания для самостоятельной работы
- •Общие правила техники безопасности при работе в эколого-аналитической лаборатории.
- •Допустимые значения концентраций загрязняющих веществ в питьевой воде
- •Обобщенные показатели
- •Органолептические показатели
- •Показатели качества воды рыбохозяйственных водных объектов
- •Нормативы предельно допустимых концентраций химических и иных веществ в воде рыбохозяйственных водных объектов (выборочно)
Работа 7. «Определение содержания основных анионов в природных водах. Определение содержания сульфат-ионов различными методами. Определение содержания хлорид-ионов методм Мора».
Цель работы: определить количественные характеристики химического состава природных вод по содержанию хлорид- и сульфат-ионов.
Сульфаты – распространенные компоненты природных вод. Их присутствие в воде обусловлено растворением некоторых минералов – природных сульфатов (гипс), а также переносом с дождями содержащихся в воздухе сульфатов. Последние образуются при реакциях окисления в атмосфере оксида серы (IV) до оксида серы (VI), образования серной кислоты и ее нейтрализации (полной или частичной):
![]()
![]()
Сульфаты присутствуют практически во всех поверхностных водах и являются одними из важнейших анионов. Главным источником сульфатов в поверхностных водах являются процессы химического выветривания и растворения серосодержащих минералов, в основном гипса, а также окисления сульфидов и серы:
![]()
![]()
Значительные количества сульфатов поступают в водоемы в процессе отмирания организмов, окисления наземных и водных веществ растительного и животного происхождения и с подземным стоком. В больших количествах сульфаты содержатся в шахтных водах и в промышленных стоках производств, в которых используется серная кислота, например, окисление пирита. Сульфаты выносятся также со сточными водами коммунального хозяйства и сельскохозяйственного производства. Сульфаты активно участвуют в сложном круговороте серы. При отсутствии кислорода под действием сульфатредуцирующих бактерий они восстанавливаются до сероводорода и сульфидов, которые при появлении в природной воде кислорода снова окисляются до сульфатов. Растения и другие автотрофные организмы извлекают растворенные в воде сульфаты для построения белкового вещества. После отмирания живых клеток гетеротрофные бактерии освобождают серу протеинов в виде сероводорода, легко окисляемого до сульфатов в присутствии кислорода.
Наличие сульфатов в промышленных сточных водах обычно обусловлено технологическими процессами, протекающими с использованием серной кислоты (производство минеральных удобрений, производства химических веществ). Сульфаты в питьевой воде не оказывают токсического воздействия на человека, однако ухудшают вкус воды: ощущение вкуса сульфатов возникает при их концентрации 250–400 мг/л. Сульфаты могут вызывать отложение осадков в трубопроводах при смешении двух вод с разным минеральным составом, например сульфатных и кальциевых (в осадок выпадает СаSO4).
ПДК сульфатов в воде водоемов хозяйственно-питьевого назначения составляет 500 мг/л, лимитирующий показатель вредности – органолептический.
Хлориды присутствуют практически во всех пресных поверхностных и грунтовых водах, а также в питьевой воде в виде солей металлов. В речных водах и водах пресных озер содержание хлоридов колеблется от долей миллиграмма до десятков, сотен, а иногда и тысяч миллиграммов на литр. В морских и подземных водах содержание хлоридов значительно выше - вплоть до пересыщенных растворов и рассолов. Хлориды являются преобладающим анионом в высокоминерализованных водах. Концентрация хлоридов в поверхностных водах подвержена заметным сезонным колебаниям, коррелирующим с изменением общей минерализации воды. Первичными источниками хлоридов являются магматические породы, в состав которых входят хлорсодержащие минералы (содалит, хлорапатит и др.), соленосные отложения, в основном галит. Значительные количества хлоридов поступают в воду в результате обмена с океаном через атмосферу, взаимодействия атмосферных осадков с почвами, особенно засоленными, а также при вулканических выбросах. Возрастающее значение приобретают промышленные и хозяйственно-бытовые сточные воды. Повышенные содержания хлоридов ухудшают вкусовые качества воды, делают ее малопригодной для питьевого водоснабжения и ограничивают применение для многих технических и хозяйственных целей, а также для орошения сельскохозяйственных угодий. Концентрации хлоридов и их колебания, в том числе суточные, могут служить одним из критериев загрязненности водоема хозяйственно-бытовыми стоками. Если в воде присутствует хлорид натрия, она имеет соленый вкус уже при концентрациях свыше 250 мг/л; в случае хлоридов кальция и магния соленость воды возникает при концентрациях свыше 1000 мг/л. Именно по органолептическому показателю – вкусу установлена ПДК для питьевой воды по хлоридам (300 мг/л), лимитирующий показатель вредности – органолептический.
Большие количества хлоридов могут образовываться в промышленных процессах концентрирования растворов, ионного обмена, высоливания и т.д., образуя сточные воды с высоким содержанием хлорид-аниона.
Высокие концентрации хлоридов в питьевой воде не оказывают токсического воздействия на человека, хотя соленые воды очень коррозионно активны по отношению к металлам, пагубно влияют на рост растений, вызывают засоление почв.
ЗАДАНИЕ 1. Определение содержания сульфат-ионов с помощью мутномера.
Средства измерения, вспомогательные устройства, реактивы и оборудование: мутномер, пипетка на 2 мл или на 5 мл с резиновой грушей (медицинским шприцем) и соединительной трубкой, пипетка-капельница, пробирки мутномерные с рисунком-точкой на дне и резиновым кольцом-фиксатором, пробка для мутномерной пробирки. Раствор нитрата бария (насыщенный), раствор соляной кислоты (20%), исследуемая природная или сточная вода.
Метод измерения. Метод определения массовой концентрации сульфат-аниона основан на реакции сульфат-анионов с катионами бария с образованием нерастворимой суспензии сульфата бария по реакции:
![]()
Требования безопасности. При измерениях следует выполнять правила работы со стеклом, электронагревательными приборами, растворами кислот и оснований, сильных окислителей.
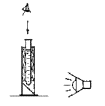
Подготовка к выполнению измерений. Экран мутномера устанавливают под углом около 45° к подставке. Работа проводится при рассеянном, но достаточно сильном (200–500 Лк) дневном (искусственном, комбинированном) освещении экрана мутномера. В каждое отверстие мутномера вставляют мутномерную пробирку с надетым на нее резиновым кольцом в положении, фиксирующем пробирку таким образом, чтобы нижняя ее часть была выдвинута в вырез мутномера на расстояние около 1 см (при этом дно пробирки окажется на требуемом расстоянии – около 2 см от экрана).
Выполнение измерений
|
1. Поместите в отверстия мутномера две пробирки с рисунком на дне. В одну из пробирок налейте анализируемую воду до высоты 100 мм (20–30 мл). 2. Добавьте к содержимому пробирки пипетками 2 капли раствора соляной кислоты и 14–15 капель раствора нитрата бария. |
|
|
|
3. Герметично закройте пробирку пробкой и встряхните, чтобы перемешать содержимое. 4. Пробирку с раствором оставьте на 5–7 мин. для образования белого осадка (суспензии). 5. Закрытую пробирку снова встряхните, чтобы перемешать содержимое. 6. Пипеткой переносите образовавшуюся суспензию во вторую (пустую) пробирку до тех пор, пока в первой пробирке не появится изображение рисунка на дне*. Измерьте высоту столба суспензии в первой пробирке (h1, мм). Наблюдение проводите, как показано на рисунке (направляя свет на вращающийся экран мутномера, установленный под углом 45°). |
|
7. Продолжайте
переносить суспензию до тех пор, пока
в ней не скроется изображение рисунка.
Измерьте высоту столба суспензии во
второй пробирке (h2, мм).
8. Рассчитайте
среднее арифметическое измерений
высоты столба суспензии (h) по
формуле:
|
Таблица 1